时间:2017-08-06 10:47:19
1、选择题 已知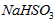 溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的
溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的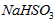 溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的关系中(R表示S或C),一定正确的是
溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的关系中(R表示S或C),一定正确的是
[? ]
A.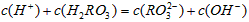
B.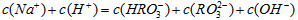
C.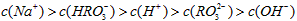
D.两溶液中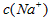 .
.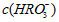 .
.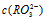 分别相等
分别相等
参考答案:A
本题解析:
本题难度:一般
2、选择题 今有室温下四种溶液,有关叙述不正确的是 
[? ]
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va L④与Vb L②溶液混合后,若混合后溶液pH=4,则Va:Vb=11:9
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列过程或现象与盐类水解无关的是( ? )
A.纯碱溶液滴入酚酞变红
B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深
D.用氯化铵溶液除去铁锈
参考答案:B
本题解析:
本题难度:简单
4、选择题 用物质的量都是0.1?mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是
[? ]
A.c(H+)<c(OH-)?
B.c(CH3COOH)+c(CH3COO-)=0.2?mol/L
C.c(CH3COOH)>c(CH3COO-)?
D.c(CH3COO-)+c(OH-)=0.2?mol/L
参考答案:B
本题解析:
本题难度:一般
5、填空题 现有浓度均为0.1?mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______.
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)______.
(3)将①和⑧等体积混合后,混合液中各离子浓度关系正确的是______.
A.c(H+)>c(SO42- )>c(NH4+)>c(OH-)
B.c(H+)=c(SO42- )=c(NH4 +)>c(OH-)
C.c(NH4+ )>c(H+)=c(SO42- )>c(OH-)
D.c(OH-)>c(H+)>c(NH4+)=c(SO42- )
参考答案:(1)这四种溶液中,其中①、②、③对水的电离起到抑制作用,只有④对水的电离起到促进作用,所以④中H+浓度大,由水的离子积可计算①中C(H+)=5×10-14mol/L、②C(H+)>10-13mol/L、③C(H+)=10-13mol/L,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(2)⑧为弱电解质的水溶液,NH4+离子浓度最小,⑦中H+浓度最大,NH4+的水解程度最小,NH4+浓度最大,⑤醋酸铵为弱酸弱碱盐,Ac-与NH4+发生互促水解,浓度最小,则)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是⑦④⑤⑧,故答案为:⑦④⑤⑧;
(3)将①和⑧等体积混合,反应后的溶液为NH4HSO4,溶液呈酸性,则D错误,存在的NH4+的水解,则c(SO42- )>c(NH4+),所以B、C错误,
故答案为:A.
本题解析:
本题难度:一般