时间:2017-08-06 10:44:46
1、填空题 (6分)(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用同样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为 。
(2)NO2可用氨水吸收生产硝酸铵,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液中滴加bL氨水后溶液显中性,则滴加氨水的过程中水的电离平衡将会 (填“正向”、“逆向”或“不”) 移动,所滴加氨水的浓度为 mol/L。(已知氨水的电离平衡常数Kb=2×10-5)
参考答案:(6分) (1) HA、HC、HB、HD (2)NH4++H2O NH3·H2O+H+ ,逆向 ,
NH3·H2O+H+ ,逆向 ,
本题解析:(1)相同物质的量浓度的NaD和NaB溶液的pH,前者比后大,NaA溶液呈中性,根据越弱越水解,水解后碱性越强可知HB比HD强,但二者都是弱酸,HA的盐不会水解证明是强酸;lmol/l的KC溶液遇酚酞试液呈红色,HC的盐会水解显碱性证明是弱酸;同体积,同物质的量浓度的HB,HC用的装置分别做导电性试验,发现后者的灯泡比前者亮,说明HC的电离程度大于HB的电离程度,HC强于HB,综上所述:HA>HC>HB> HD;
(2)硝酸铵溶液呈酸性原因是NH4+离子水解:NH4+ + H2O  NH3·H2O + H+,水中存在H2O
NH3·H2O + H+,水中存在H2O  H+ + OH-,当加入铵根离子后,铵根离子与OH-结合形成氨水分子NH4++ OH-
H+ + OH-,当加入铵根离子后,铵根离子与OH-结合形成氨水分子NH4++ OH- NH3·H2O,消耗的OH-由水分子继续电离提供,因此铵根水解的过程实际上是水分子电离增大的过程,然后向溶液中滴加氨水,由于氨水电离提供的OH-要远大于水电离提供的OH-,这样滴加氨水后,水分子的电离程度是减小的,选“逆向”; 根据氨水电离方程NH3·H2O
NH3·H2O,消耗的OH-由水分子继续电离提供,因此铵根水解的过程实际上是水分子电离增大的过程,然后向溶液中滴加氨水,由于氨水电离提供的OH-要远大于水电离提供的OH-,这样滴加氨水后,水分子的电离程度是减小的,选“逆向”; 根据氨水电离方程NH3·H2O  NH4+ + OH-,[OH-]=(Kb×[NH3?H2O])/[NH4+],由于溶液体积不管最终是多少,NH4+与NH3?H2O浓度比与其物质的量之比相同,即[OH-]=Kb×n(NH3?H2O)/n(NH4+) , 10-7=2×10-5n(NH3?H2O)/a, 解得 n(NH3?H2O)=a/200,所滴加氨水的浓度为
NH4+ + OH-,[OH-]=(Kb×[NH3?H2O])/[NH4+],由于溶液体积不管最终是多少,NH4+与NH3?H2O浓度比与其物质的量之比相同,即[OH-]=Kb×n(NH3?H2O)/n(NH4+) , 10-7=2×10-5n(NH3?H2O)/a, 解得 n(NH3?H2O)=a/200,所滴加氨水的浓度为 mol/L。
mol/L。
考点:考查弱电解质的电离,盐的水解等知识。
本题难度:困难
2、选择题 Na2S溶液中存在多种粒子,下列各粒子间的关系正确的是
A.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
B.c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
C.c(Na+)=c(HS-)+2c(H2S)+2c(S2-)
D.c(OH-)=c(H+)+c(HS-)+2c(H2S)
参考答案:A
本题解析:电解质的水溶液中存在两个守恒:①物料守恒,②电荷守恒.通俗地说:①任何一种元素的粒子数既不能增加也不会减少;②电解质溶液中存在各种带电的粒子,但所带电荷量的代数和等于零,即溶液不带电.结合本题有如下两个等式(在同一体积中,用浓度表示即可):
物料守恒:c(Na+)=2c(HS-)+2c(H2S)+2c(S2-)①
电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)②
在物料守恒中,应该找出该元素可能转化生成的各种粒子.如本题的硫元素,它来源于Na2S中的S2-,少量的S2-要水解转化成HS-,微量的HS-进一步水解转化成H2S.所以含硫元素的各种粒子总数与钠离子的粒子数之比应符合原化学式中粒子的比值.
在电荷守恒中,如何计算带多个单位电荷的粒子所带电荷量,往往容易出现误解.
浓度只表示该粒子在单位体积里其物质的量(粒子)的多少,并不表示它带电荷量的多少.用其所带电荷数乘以其浓度,等于其所带电荷量.
D为溶液中的质子守恒,正确.
本题难度:困难
3、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,1 mol氦气含有的电子数目为4NA
B.若CH3COONa溶液中CH3COO-的数目为NA,则Na+的数目大于NA
C.一定条件下,1 mol N2和3 mol H2混合,反应转移的电子数目为6NA
D.标准状况下,11.2 L己烷中含有的化学键数目为9.5NA
参考答案:B
本题解析: A.He是单原子分子,所以常温常压下,1 mol氦气含有的电子数目为2NA,错误;B.CH3COONa是强碱弱酸盐,CH3COO-会发生水解反应而消耗。若CH3COONa溶液中CH3COO-的数目为NA,则Na+的数目大于NA,正确;C.一定条件下,1 mol N2和3 mol H2混合发生反应,由于该反应是可逆反应,反应不可能进行到底,所以转移的电子数 目小于6NA,错误;D.标准状况下,己烷的状态是液态,所以不能使用气体摩尔体积来计算,错误。
考点:考查阿伏加德罗常数的有关计算的知识。
本题难度:一般
4、选择题 下列溶液中微粒浓度关系不正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
参考答案:AC
本题解析:氨水与氯化铵的混合溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),常温下溶液pH=7,即c(H+)=c(OH-),所以c(NH4+)=c(Cl-),A项正确;选项B,没有指明酸、碱的强弱,故不能判断溶液的酸碱性,B项错;(NH4)2SO4中NH4+的水解是微弱的(水解显酸性),故0.1 mol·L-1的(NH4)2SO4溶液中:0.1 mol·L-1<c(NH4+)<0.2 mol·L-1,则有c(NH4+)>c(SO42-)>c(H+)>c(OH-),C项正确;硫化钠溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),存在物料守恒:c(Na+)=2[c(HS-)+c(S2-)+c(H2S)],由两式联立可得c(OH-)=c(HS-)+2c(H2S)+c(H+),D项错。
本题难度:困难
5、填空题 (10分)(1)AgNO3的水溶液呈 (填“酸”“中”或“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其水解。
(2)明矾溶于水其中铝离子水解可用于净水,用离子方程式表示:
(3)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):
参考答案:(1)酸 Ag+ + H2O 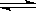 AgOH + H+ 抑制 (2)Al3+ +3H2O
AgOH + H+ 抑制 (2)Al3+ +3H2O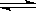 Al(OH)3 +3H+
Al(OH)3 +3H+
(3)CO32- + H2O 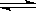 HCO3- +OH-
HCO3- +OH-
本题解析:(1)AgNO3是强酸弱碱盐,水解显酸性,水解的离子方程式为Ag+ + H2O 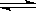 AgOH + H+由于水解会生成杂质,所以加入硝酸来抑制水解。(2)铝离子水解的离子方程式为:Al3+ +3H2O
AgOH + H+由于水解会生成杂质,所以加入硝酸来抑制水解。(2)铝离子水解的离子方程式为:Al3+ +3H2O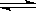 Al(OH)3 +3H+(3)纯碱是碳酸钠,是强碱弱酸盐,水解溶液显碱性,碱性条件下油污会发生水解而被除去,CO32-水解的离子方程式为:CO32- + H2O
Al(OH)3 +3H+(3)纯碱是碳酸钠,是强碱弱酸盐,水解溶液显碱性,碱性条件下油污会发生水解而被除去,CO32-水解的离子方程式为:CO32- + H2O 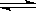 HCO3- +OH-
HCO3- +OH-
考点:盐类水解的应用和离子方程式的书写。
本题难度:一般