时间:2017-08-06 10:41:37
1、选择题 下列有关化学用语表示正确的是
[? ]
A.N2的电子式: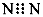
B.S2-的结构示意图: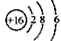
C.质子数为53,中子数为78的碘原子:13153I
D.邻羟基苯甲酸的结构简式: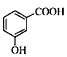
参考答案:C
本题解析:
本题难度:简单
2、填空题 氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
请回答下列问题:
(1)写出铬原子的基态电子排布式________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。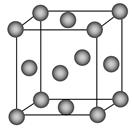
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________。
参考答案:(1)1s22s22p63s23p63d54s1 K、Cu 4
(2)非极性 (3)①③ 直线形
本题解析:(1)铬元素是24号元素,处于第4周期,电子排布式为1s22s22p63s23p63d54s1,其最外层只有一个电子,同周期中原子最外层只有一个电子的元素还有K、Cu。根据晶胞图示可知,金属原子的数目为8×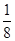 +6×
+6×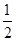 =4。
=4。
(2)CCl4、CS2均为非极性分子,根据相似相溶原理可知,CrO2Cl2为非极性分子。
(3)涉及含C的物质,若C都成单键为sp3杂化;共成一个双键则为sp2杂化;共成一个叁键和二个双键则为sp1杂化。
本题难度:一般
3、填空题 (12分)主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3 倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
⑴W元素原子的L层电子排布式为?,W3分子的空间构型为?;
⑵化合物M的化学式为?,其晶体结构与NaCl相同,而熔点高于NaCl。M熔
点较高的原因是?;
⑶将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中O—C—O的键角约为?;
⑷X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z=?。?
参考答案:⑴2s22p4(2分)V形(2分)? ⑵MgO(2分)离子电荷多,晶格能大(2分)
⑶120°(2分)? ⑷3:1:1(2分)
本题解析:W的原子最外层电子数是次外层电子数的3 倍,则W水氧元素。熔点高的也不是原子晶体或离子晶体。根据形成的是二组分化合物可判断,M是氧化镁,即Y是镁元素。因此X是氟元素,Z是钾元素。
(1)根据构造原理可知氧元素的L层电子排布式为2s22p4。臭氧是3原子电子的V形结构。
(2)由于氧化镁中离子电荷多,晶格能大,熔点高。
(3)碳酸分子是碳原子是sp2杂化,所以键角是120°的。
(4)X占据所有棱的中心,则含有X是12×1/4=3。Y位于顶角,则Y是8×1/8=1。Z处于体心位置,则该晶体的组成为X︰Y︰Z=3︰1︰1。
本题难度:一般
4、选择题 CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
A.铊的元素符号为Tl
B.铊原子的质子数为81
C.铊位于第六周期ⅢA族
D.铊的金属性比铝的金属性弱
参考答案:A.由图可知,铊的元素符号为Tl,故A正确;
B.图示中左上角的数字为质子数,则Tl的质子数为81,故B正确;
C.由“6s26p1”表示铊原子有6个电子层,最外层有3个电子.则Tl位于元素周期表中第六周期第ⅢA族,故C正确;
D.同主族从上到下元素的金属性在增强,则铊的金属性比铝的金属性强,故D错误;
故选D.
本题解析:
本题难度:简单
5、填空题 由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题。
(1)该配位化合物X的化学式为?。
(2)元素B、C、D的第一电离能的由小到大排列顺序为?。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________?。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为?。
(5)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如下图:其中碳原子的杂化方式有____??。碳铂中含有的作用力有?(填字母)。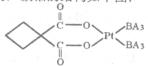
A.共价键
B.配位键
C.金属键
D.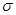 键
键
E.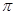 键
键
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式?。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为p=?g/cm3。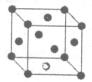
参考答案:(1)(1)Cu(NH3)4SO4×H2O (2分)
(2)S<O<N (1分)
(3)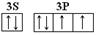 (1分)
(1分)
(4)H2O与H2O2之间形成氢键(2分)
(5)sp3和sp2(2分)ABDE(2分)
(6)6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O(3分);?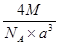 ?(2分)
?(2分)
本题解析:(1)由题意可推知A为H元素,B为N元素,C为O元素,D为S元素,E元素的外围电子排布为(n-l)dn+6ns1,E为Cu元素,该配位化合物X的化学式为Cu(NH3)4SO4×H2O
(2)N、O、S三种元素中,N的2p轨道是半充满状态,所以第一电离能最大,O、S同主族,同主族元素的第一电离能从上到下逐渐减小,所以N、O、S三种元素的第一电离能从小到大的排列顺序是S<O<N
(3)D为S元素,最外层电子是6个电子,电子排布式是3s23p6,轨道表示式为
(4)H、O元素可形成化合物H2O与H2O2,二者之间能互溶是因为H2O与H2O2之间形成氢键
(5)C原子周围形成4个共价单键为sp3杂化,形成2个共价单键和1个双键是sp2杂化;碳铂中单键为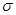 键,双键中有1个为
键,双键中有1个为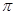 键,且Pt与N原子间形成配位键,所以碳铂中含有的作用力有共价键、配位键、
键,且Pt与N原子间形成配位键,所以碳铂中含有的作用力有共价键、配位键、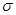 键、
键、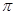 键,答案选ABDE;
键,答案选ABDE;
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,则Y为CuH,与稀硝酸反应得蓝色溶液为硝酸铜溶液,两种气体为氢气、一氧化氮,所以该反应的化学方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;该晶胞中实际含4个Cu,其质量为4×M/NA,晶胞体积为a3cm3,所以该晶胞密度的计算式为ρ=4×M/NA/ a3= 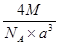 ?g/cm3
?g/cm3
本题难度:困难