时间:2017-08-06 10:41:37
1、选择题 下列有关叙述中,正确的是
[? ]
A.Na2O2固体中,阳离子与阴离子的个数比为1:1
B.CH3Cl的电子式为: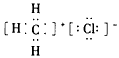
C.核素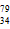 Se中的质子数为34,中子数为79
Se中的质子数为34,中子数为79
D.氧原子的结构示意图为: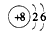
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列用电子式表示化合物的形成过程,正确的是
[? ]
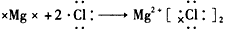
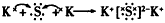
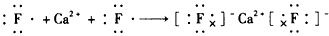
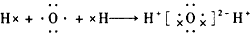
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列叙述不正确的是( )
A.漂白粉的有效成分是Ca(ClO)2
B.胆矾的成分是CuSO4?5H2O
C.医疗上用的“钡餐”成分是BaSO4
D.光导纤维主要成分是Si
参考答案:A、漂白粉的成分是氯化钙与次氯酸钙,次氯酸钙具有强氧化性,有效成分是次氯酸钙,故A正确;
B、五水硫酸铜也被称作硫酸铜晶体,俗称蓝矾、胆矾,故B正确;
C、BaSO4不溶于水和脂质,是药用钡餐的成分,故C正确;
D、光导纤维的主要成分是二氧化硅,硅用于光电池、芯片材料,故D错误.
本题解析:
本题难度:简单
4、选择题 2007年9月,美国科学家宣称:普通盐水在某种无线电波照射下可以燃烧,这一发现,有望解决用水作人类能源的重大问题。无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种电波下持续燃烧。上面所述中“结合力”的实质是( )
A.分子间作用力
B.氢键
C.非极性共价键
D.极性共价键
参考答案:D
本题解析:无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,这说明水分子中的极性键断键,释放出氢原子,所以上面所述中“结合力”的实质是极性共价键,答案选D。
点评:该题以新科技为载体,属于中等难度的试题。侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:简单
5、填空题 长期以来一直认为氟的含氧酸不存在.但是至1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了.他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸.
(1)以下两种结构式,能正确表示次氟酸结构的是______.A、H-O-F?B、H-F-O
(2)次氟酸中氧元素的化合价为______,次氟酸的电子式为______,次氟酸分子中共价键的键角______180°(填“<”或“=”).
(3)下面给出了几个分子和基团化学键的键能:
H2
O2
F2
OH
OF
HF
E/(kJ/mol)
432
494
155
424
220
566
请计算反应 2HOF(g)=2HF(g)+O2(g)的反应热(△H),近似为______kJ/mol.从计算结果预测次氟酸的一条化学性质:______.
(4)次氟酸能被热水瞬间分解,生成一种常见的物质M,M是18e-,且被称为“绿色氧化剂”.写出次氟酸与热水反应的化学方程式:______.
参考答案:(1)因HFO为共价化合物,根据共价键成键的特点,氢原子形成一对共用电子对,氧原子形成两对共用电子对,氟原子形成一对共用电子对,其结构式为H-O-F,故答案为:A;
(2)因为F元素吸引电子对的能力比O元素强,在次氟酸中F元素呈-1价,H元素为+1价,则O元素呈零价,次氟酸的电子式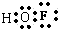
,次氟酸中心原子是氧,采用sp3杂化,分子中共价键的键角<180°,
故答案为:0;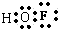
;<;
(3)反应热=反应物的总键能-生成物的总键能=424KJ/mol×2+220 KJ/mol×2-566KJ/mol×2-494KJ/mol=-338KJ/mol,次氟酸分解放出大量的热,故有强氧化性,故答案为:-338;具有强氧化性;
(4)被称为“绿色氧化剂”的过氧化氢(H2O2),次氟酸与热水反应的化学方程式:HOF+H2O=△=HF+H2O2,
故答案为:HOF+H2O=△=HF+H2O2;
本题解析:
本题难度:一般