时间:2017-08-06 10:23:40
1、实验题 某化学课 外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。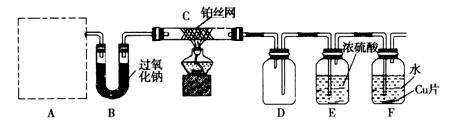
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________________(填代表备选试剂的序号);此时A中主要的玻璃仪器有__________________________________(填名称)。
(2)下面关于A中所用试剂的说法正确的是___________________。
A.施用该物质会大大提高粮食产量而对环境无影响
B.向该物质的溶液中加入足量氢氧化钡溶液发生反应的离子方程式为:NH4+ + OH– = NH3?H2O
C.可通过加热方法区别该试剂和(NH4)2SO4
D.工业上用NH3等合成该物质的过程可称为氮的固定
(3)装置C中发生催化氧化反应的化学方程式为_________________________,装置E发生反应的化学方程式为_________________________________________________。
(4)假设A、B中的药品充足,则装置F中可以观察到的现象有________________________
___________________________________________________________________ __。
__。
(5)指导老师从安全与环保角度考虑,指出该装置有两处明显的缺陷,请你提出修改建议:_____________________________________________________________________________________ ____________________________________________________________。
____________________________________________________________。
参考答案:(1) NH4HCO3(2分)?试管、酒精灯(2分)? (2) C(2分)
(3) 4NH3 + 5O2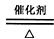 4NO + 6H2O(2分)? 2NH3 + H2SO4 = (NH4)2SO4(2分)
4NO + 6H2O(2分)? 2NH3 + H2SO4 = (NH4)2SO4(2分)
(4)水中产生气泡,溶液逐渐变为蓝色,气体在 广口瓶上方变为红棕色(3分)
广口瓶上方变为红棕色(3分)
(5)在装置E、F之间增加一个防倒吸装置,在装置F后面增加一个尾气吸收装置(2分)
本题解析:略
本题难度:一般
2、实验题 (13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2?(1)
平均反应速率的计算式为v(S2O82-)=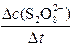 。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="?" S4O62-+ 2I-?(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实?验?编?号 | ① | ② | ③ | ④ | ⑤ | |
| ? 试剂 用量 (mL) | 0.20? mol·L-1(NH4)2S2O8溶液 | 20.0 | 10.0 | ?b | 20.0 | 20.0 |
| 0.20? mol·L-1 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010? mol·L-1 Na2S2O3溶液 | ?a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20? mol·L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | ?c | |
| 0.20? mol·L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ℃时,反应时间Δt(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||

参考答案:(13分)
I(1)a? 8.0?(1分)? b? 5.0?(1分)? c? 15.0?(1分)
(2)搅拌?(1分)?(3)2.5 × 10-5?(2分)(4)反应物浓度增大反应速率加快;反应速率变化和反应物起始浓度变化存在比例关系;反应物浓度对反应速率的影响和化学计量数无关等(只答浓度对化学反应速率有影响不给分)?(1分)
II(1)①Na2S溶液、Na2CO3溶液(2分)②NaOH溶液…(不写溶液不得分)(1分)
(2)沉淀逐渐消失?(1分)?(3)加热浓缩,冷却结晶,过滤(2分)
本题解析:略
本题难度:简单
3、选择题 学习化学不限于书本和实验室,成功的关键在于如何激发自己对于自然现象的兴趣,学习并逐步掌握( )的方法和养成良好科学习惯.
A.观察
B.科学探究
C.思考
D.交流
参考答案:B
本题解析:
本题难度:一般
4、简答题
工业上常用铁质容器盛装冷浓硫酸,为研究铁质材料与热浓硫酸的反应,某学校学习小组进行以下探究实验:
[一](1)将已除去表面氧化物的铁钉(碳素钢)放入冷的热的浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是??;
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用?
(选填序号)
a.KSCN溶液和氯水 .b铁.粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应SO2+Br2+2H2O═2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g由于此推知气体Y中SO2的体积分数为?;
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体,为此设计了下列探究实验装置(图中夹持仪器省略)
(3)装置B中试剂的作用是??;
(4)认为气体Y中还含有Q的理由是?;(用化学方程式表示)
(5)为确认Q的存在,需在装置中添加M于??(选填序号)
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验的现象应是?;
(7)若要测定限定体积气体Y中H2含量(标准状况下约有28ml H2),除用测量H2体积方法外,否选用质量称量方法?做出判断并说明理由??。
参考答案:(1)铁钉表面已经被氧化
(2)① d?
②66.7%
(3)检验SO2是否被完全除尽
(4)C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)c
(6)D中固体由黑色变红和E中固体由白变蓝
(7) 否,用托盘天平无法称量D或E的差量。
本题解析:(1)铁钉放入冷硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,故答案为:铁钉表面被氧化;
(2)①亚铁离子能使酸性高锰酸钾褪色,溶液中已经有三价铁离子,选择a会造成干扰,b能检验三价铁离子的存在,选c生成两种沉淀,受氢氧化铁沉淀颜色的影响无法分辨。
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,则n(混合气体)=0.336L/22.4L/mol==0.015mol;
SO2 ~BaSO4
1mol?233g
n? 2.33g? n=0.01mol
所以二氧化硫的体积分数为:0.01mol/0.015mol×100%=66.7%。
(3)A除去二氧化硫,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫。
(4)在加热时,铁钉中不仅铁和浓硫酸反应,碳也和浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓)  CO2 ↑+2SO2↑+2H2O。
CO2 ↑+2SO2↑+2H2O。
(5)Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收。
(6)氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝色,同时有红色的铜单质生成。(7)中学阶段质量的称量选择托盘天平,分度值是0.1g,所以无法精确称量出D或E的差量。
本题难度:一般
5、实验题 某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理。(装置气密性已检查完毕)。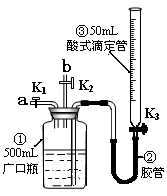
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作:?;
②从导管a通入一定量的NO,并记录滴定管读数,求出液面变化的数值为VL(V<50mL,气体体积已换算为标准状况)。准确测定NO的体积的主要操作:?;
(2)验证NO的还原性;探究工业生产硝酸的原理
①、停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是?,写出对应现象的化学反应方程式?、?;
②、继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i?当通入氧气的体积为1/2V时,则广口瓶①的气体体积为?;
ii 当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为?mol/L。
参考答案:(每空2分)
(1)①打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排出(或者让水充满①)且调节滴定管中液面与①相平并记录滴定管的刻度。
②关闭K2、打开K3、K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管的刻度。(未打开或关闭,此空0分)
(2)①气体先变为红棕色,?(1分)?然后逐渐变淡。(1分),
2NO + O2 = 2NO2?,3NO2 + H2O = 2HNO3 + NO 。
②______ V/3_______________,___________ V/11.2 mol/L? __
本题解析:略
本题难度:一般