时间:2017-08-06 10:13:24
1、选择题 在电解水时,为了增强导电性,加入的电解质最好选用( )
A.Na2SO4
B.HCl
C.NaCl
D.CuSO4
参考答案:A.加入Na2SO4,增大溶液浓度,导电性增强,且不影响H2和O2的生成,故A正确;
B.加入HCl,一极析出氢气,另一极产生氯气,影响氧气的生成,故B错误;
C.加入NaCl,发生2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,生成氯气,不全部为水的电解,故C错误;
D.加入CuSO4,在阴极上析出铜,影响氢气的生成,不全部为水的电解,故D错误.
故选A.
本题解析:
本题难度:一般
2、填空题 (16分)Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |

参考答案:Ⅰ.3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= —4.2kJ/mol
或6Na2O(s)+2C(s,金刚石) =8Na(g)+2Na2CO3(l) △H= —8.4kJ/mol
(2分,方程式1分,△H的表示1分,状态错误0分;“—”、焓变数值、单位错漏合扣1分)
Ⅱ.
(1)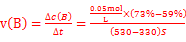 (2分,结果写单位也可,单位错漏扣1分, 计算出结果:3.5×10-5mol/(L.s)也给分,合理即给分)
(2分,结果写单位也可,单位错漏扣1分, 计算出结果:3.5×10-5mol/(L.s)也给分,合理即给分)
(2) O2NC6H4COOC2H5 + OH-  O2NC6H4COO- + C2H5OH
O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75% (1分)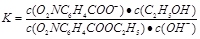 (1分)
(1分) 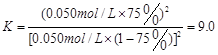 (2分)
(2分)
(共4分,其中:三段式1分,K的表达式1分,代入数值1分,计算结果1分。单位错漏扣1分,全部不带单位不扣分,有效数字错误不扣分,其他合理解法也给分)
(3)升高温度,增大OH-的浓度,移去产物(任答2条,共2分,合理即给分)
Ⅲ.(1)Al-3e-=Al3+或2Al-6e-=2Al3+(2分)
2H2O+2e-=2OH-+H2 ↑或6H2O+6e-=6OH-+3H2 ↑
或 2H++2e-=H2 ↑或 6H++6e-=3H2 ↑(2分)
(2)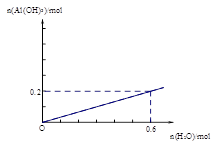 (2分,其中,曲线1分,标注1分)
(2分,其中,曲线1分,标注1分)
本题解析:Ⅰ 由盖斯定律可知:固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式:3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= -3/2×(-357.5kJ/mol)+1/2(-1080.9kJ/mol)= —4.2kJ/mol;Ⅱ、(1)根据速率公式: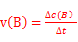 ,该反应在330~530s的平均反应速率为
,该反应在330~530s的平均反应速率为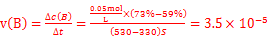 mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH-
mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH-  O2NC6H4COO- + C2H5OH
O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75%
则K=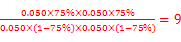 ;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH-
;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为:
O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为: 。
。
考点:化学反应原理综合。
本题难度:困难
3、选择题 用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是
A.AgNO3[AgNO3]
B.NaOH[NaOH]
C.KCl[KCl]
D.CuSO4[CuO]
参考答案:D
本题解析:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,就加入什么物质,即可使溶液完全复原。对几个选项的详细分析:A中4AgNO3+2H2O 4Ag+O2↑+4HNO3,脱离反应体系的物质是4Ag+O2,相当于2Ag2O,故应当加入适量Ag2O才能复原,若加入AgNO3,会使NO3-的量增加。B中2H2O
4Ag+O2↑+4HNO3,脱离反应体系的物质是4Ag+O2,相当于2Ag2O,故应当加入适量Ag2O才能复原,若加入AgNO3,会使NO3-的量增加。B中2H2O 2H2↑+O2↑,脱离反应体系的是2H2+O2,相当于2H2O,故加入适量水可以复原。C中2KCl+2H2O
2H2↑+O2↑,脱离反应体系的是2H2+O2,相当于2H2O,故加入适量水可以复原。C中2KCl+2H2O 2KOH+H2↑+Cl2,脱离反应体系的是H2+Cl2,相当于2HCl,故应通入适量HCl气体才能复原,若加入盐酸时,同时又增加了水。D中2CuSO4+2H2O
2KOH+H2↑+Cl2,脱离反应体系的是H2+Cl2,相当于2HCl,故应通入适量HCl气体才能复原,若加入盐酸时,同时又增加了水。D中2CuSO4+2H2O 2H2SO4+2Cu+O2↑,脱离体系的是2Cu+O2,相当于2CuO,故加入适量CuO可以复原。
2H2SO4+2Cu+O2↑,脱离体系的是2Cu+O2,相当于2CuO,故加入适量CuO可以复原。
考点:电解原理
本题难度:一般
4、填空题 (8分)下图为以惰性电极进行电解。
完成下列问题
(1)A电极的现象是?B电极的电极反应方程式?
D电极的反应方程式??
(2)若电路中通过1mol电子,C电极的增重为?g
参考答案:(8分
(1)有红色固体析出、? 2Cl—+? 2e-= Cl2? 4OH—- 4e- = 2H2O + O2 ↑
(2)108
本题解析:连接外电源负极的A、C为电解池的阴极,而B、D为阳极
左池A极:Cu2++2e-=Cu? B极:2Cl—+? 2e-= Cl2↑
右池C极:Ag++e-=Ag? D极:4OH—- 4e- = 2H2O + O2 ↑
(1)有红色固体析出、? 2Cl—+? 2e-= Cl2? 4OH—- 4e- = 2H2O + O2 ↑
(2)由C极的电极反应Ag++e-=Ag知,当电路中通过1mol电子时,析出银的质量为108g
本题难度:一般
5、填空题 (14分)课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:___________?_____。
(3)设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)装置丁中的现象是________________________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为?mol/L。
参考答案:(1)负极?(2)CuSO4+Fe Cu+FeSO4?(3)1:1
Cu+FeSO4?(3)1:1
(4)粗铜?变小?(5)Y极附近红褐色变深?(6)0.4
本题解析:(1)电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明是氢离子放电,溶液呈碱性,F极为阴极,也就是说B为负极。
(2)铁为阳极失电子,溶液中的铜离子得电子,则总反应为:CuSO4+Fe Cu+FeSO4
Cu+FeSO4
(3)由(2)可知铁、铜的物质的量相同
(4)粗铜的精炼,阳极G应该为粗铜,由于其中一些杂质金属放电,导致溶液中的铜离子浓度减小
(5)考查胶体的电泳现象
(6)由关系式Cl2~ FeSO4可知甲池中所生成的FeSO4的物质的量浓度为0.4mol/L
本题难度:一般