时间:2017-08-06 10:13:24
1、选择题 用石墨电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是
( )
A.AgNO3[AgNO3]
B.NaOH[H2O]
C.KCl[KCl]
D.CuSO4[CuO]
参考答案:石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电,
A.电解AgNO3溶液,银离子在阴极放电生成Ag,氢氧根离子在阳极放电生成氧气,则应加入氧化银恢复原样,故A错误;
B.电解NaOH溶液,氢离子在阴极放电生成氢气,氢氧根离子在阳极放电生成氧气,则应加入一定量的水恢复原样,故B正确;
C.电解KCl溶液,氢离子在阴极放电生成氢气,氯离子在阳极放电生成氯气,则应加入一定量的HCl恢复原样,故C错误;
D.电解CuSO4溶液,铜离子在阴极放电生成Cu,氢氧根离子在阳极放电生成氧气,则应加入一定量的CuO恢复原样,故D正确;
故选BD.
本题解析:
本题难度:一般
2、选择题 可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应 ① Br2 + 2e-= 2Br- ② 2Br--2e-= Br2 ③ Zn - 2e-= Zn2+ ④ Zn2+ +2e-= Zn 其中表示充电时的阳极反应和放电时的负极反应的分别是
[? ]
A.②和③
B.②和①
C.③和①
D.④和①
参考答案:A
本题解析:
本题难度:一般
3、选择题 X、Y、Z、M代表四种金属,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M
B.X>Y>Z>M
C.M>Z>X>Y
D.X>Z>M>Y
参考答案:A、
本题解析:金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出,说明X作原电池的负极,则X比Z活泼;若电解Y2+离子和Z2+离子共存的溶液时,Y先析出,先析出的阳离子的氧化性强,则对应的单质的还原性弱,所以Z比Y活泼;M2+离子的氧化性强于Y2+离子,则单质的还原性M小于Y,所以Y比M活泼,则四种金属的活泼性由强到弱的顺序为X>Z>Y>M,答案选A。
考点:考查元素金属性强弱的判断
本题难度:一般
4、选择题 苹果iphone5正在我国热卖,其电池为锂电池。构造如图所示,电池内部“→”表示放电时Li+的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC6 LiCoO2+6C,下列说法错误的是
LiCoO2+6C,下列说法错误的是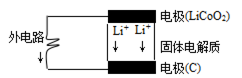
A.该电池的负极为LiCoO2
B.电池中的固体电解质可以是氯化钠、干冰等
C.充电时的阴极反应:Li1-xCoO2+xLi++xe-=LiCoO2
D.外电路上的“→”表示放电时的电子流向
参考答案:B
本题解析:A、放电时,负极上失电子化合价升高,发生氧化反应,所以LiCoO2为电池的负极,A正确;B、干冰是固体二氧化碳,为非电解质,B错误;C、充电时,阴极发生还原反应化合降低,所以电极反应式为Li1-xCoO2+xLi++xe-
本题难度:一般
5、选择题 把物质的量均为0.1 mol的AlCl3、CuCl2和H2SO4溶于水制成100 mL的混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
A.阳极得到的气体中有O2且为0.35 mol
B.铝元素仅以Al(OH)3的形式存在
C.阴极质量增加3.2 g
D.电路中共转移0.9 mol电子
参考答案:D
本题解析:根据离子的放电顺序,则在阴极放电的离子先是Cu2+,Cu2++2e-==Cu,其次是氢离子,发生2H++2e-==H2↑;在阳极放电的首先是氯离子,发生2Cl--2e-=Cl2↑,其次是氢氧根离子,发生2H2O -4e- =O2↑+4H+。根据题意,溶液中Cu2+的物质的量是0.1mol,氢离子的物质的量是0.2mol,氯离子的物质的量是0.5mol,一段时间后在两极收集到的气体在相同条件下体积相同,因为氢离子放电产生的氢气与氯离子放电产生的氯气的体积相等,所以阳极一定有氧气生成,所以阳极的氯离子一定放电完全。设阳极产生氧气的物质的量是x,则阳极:失去电子的物质的量是0.5mol+4x;则阴极产生氢气的物质的量是0.5mol/2+x,所以阴极:得到电子的物质的量是0.1mol×2+(0.5mol/2+x)×2,根据得失电子守恒,有0.5mol+4x=0.1mol×2+(0.5mol/2+x)×2,解得x=0.1mol。A、阳极得到的气体中有0.1mol氧气,错误;B、因为生成氢气的物质的量是0.35mol,则最终溶液呈碱性,硫酸根离子不放电,则铝元素以铝离子和氢氧化铝形式共同存在,错误;C、阴极增加的质量是0.1molCu的质量,为6.4g,错误;D、根据以上计算,电路中转移电子的物质的量是0.5mol+4x=0.9mol,正确,答案选D。
考点:考查电解原理的应用,离子放电顺序的判断,简单计算
本题难度:一般