时间:2017-08-06 09:23:27
1、选择题 常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
参考答案:B
本题解析:A、碳酸氢铵溶液中,N元素与C元素符合1:1的关系,所以根据元素守恒有c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),正确;B、根据图像可知,加入氢氧化钠后溶液的碱性增强,氢氧根离子先与铵根离子反应,使铵根离子浓度逐渐减小,而碳酸氢根离子稍增大后又逐渐减小,错误;C、因为0.1mol/L的NH4HCO3溶液,pH=7.8,溶液呈碱性,说明碳酸氢根离子的水解程度大于铵根离子的水程度,根据越弱越水解,所以常温下Kb(NH3·H2O)>Ka1(H2CO3),正确;D、根据图像中pH=9时曲线的高低判断,此时溶液中粒子的浓度关系是c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),正确,答案选B。
考点:考查离子浓度大小的比较,盐水解规律的应用
本题难度:困难
2、简答题 硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为  (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
参考答案:(1)xCOS(g)=XCO(g)+Sx(s)△H=0.5x(b-a)akJ/mol
(2)3NA
(3) ①HS-(或NaHS)
② c
③ c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+)
(4)①SO2+xI2+2H2O=H2SO4+2HIx
②2Ix—-2e-=xI2 2HIx=(x-1)I2+2HI
本题解析:(1)①SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
②2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。由盖斯定律可得,xCOS(g)=Xco(g)+Sx(s)△H=0.5x(b-a)akJ/mol;
(2)根据As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,若生成H3AsO4的物质的量为2mol时,电子转移为10mol,若生成H3AsO4的物质的量为0.6mol时,电子转移为3NA;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量发生的反应依次为,NaOH+HCl=NaCl+H2O、Na2S+HCl=NaCl+NaHS、NaHS+HCl=H2S+NaCl。①结合图像分析,B表示HS-;②根据元素守恒知,滴加过程中,溶液中微粒浓度大小关系为c(Na+)=3[c(H2S)+c(HS?)+c(S2?)],选c;③A表示Na2S,B表示NaHS,当滴加盐酸至M点时,表示两者含量相等,溶液中
c(Na+)=3[c(H2S)+c(HS?)+c(S2?)],则c(Na+)>c(HS-),NaHS溶液呈碱性,说明其水解大于电离,水解是微弱的,所以c(HS-)>c(S2-),硫化钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),则c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+);
(4)由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+xI2+2H2O=H2SO4+2HIX;②由题给装置图可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,电解HIx生成I2、HI,反应方程式为:2HIx
本题难度:一般
3、选择题 常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是:( )
A.三种酸的电离常数Ki(HX)> Ki(HY)> Ki(H2CO3)
B.结合H+的能力:Y->CO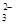 >X->HCO
>X->HCO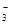
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:C(Na+)>c(HCO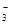 )>C(X-)>c(OH-)>c(H+)
)>C(X-)>c(OH-)>c(H+)
参考答案:B
本题解析:向NaX溶液中通CO2气体,只能生成HX和NaHCO3;则酸性H2CO3>HX> HCO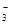 ;往NaY溶液中通入CO2则生成HY和Na2CO3。则酸性H2CO3 > HCO
;往NaY溶液中通入CO2则生成HY和Na2CO3。则酸性H2CO3 > HCO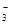 >HY;故酸性:则酸性H2CO3>HX> HCO
>HY;故酸性:则酸性H2CO3>HX> HCO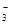 >HY; A.酸性越强,则在相同的温度下,酸的电离平衡常数就越大,所以三种酸的电离常数Ki(H2CO3) > Ki(HX)> Ki(HY) ,错误;B.酸越弱,则酸根离子结合H+的能力就越强,由于酸性:H2CO3>HX> HCO
>HY; A.酸性越强,则在相同的温度下,酸的电离平衡常数就越大,所以三种酸的电离常数Ki(H2CO3) > Ki(HX)> Ki(HY) ,错误;B.酸越弱,则酸根离子结合H+的能力就越强,由于酸性:H2CO3>HX> HCO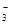 >HY;结合H+的能力:Y->CO
>HY;结合H+的能力:Y->CO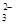 >X->HCO
>X->HCO ,正确;C.弱酸的酸性越弱,则其形成的强碱的盐溶液水解程度就越大,溶液碱性就越强,所以溶液的碱性:: NaY>Na2CO3> NaX> NaHCO3,错误;D.NaX溶液中通入足量CO2后的离子浓度:会产生HX和NaHCO3;溶液显酸性,离子浓度:C(Na+)>c(HCO
,正确;C.弱酸的酸性越弱,则其形成的强碱的盐溶液水解程度就越大,溶液碱性就越强,所以溶液的碱性:: NaY>Na2CO3> NaX> NaHCO3,错误;D.NaX溶液中通入足量CO2后的离子浓度:会产生HX和NaHCO3;溶液显酸性,离子浓度:C(Na+)>c(HCO )>C(X-)>c(H+)>c(OH-),错误。
)>C(X-)>c(H+)>c(OH-),错误。
考点:考查弱酸的电离、盐的水解、溶液中离子浓度的大小比较的知识。
本题难度:困难
4、选择题 将0.2 mol·L-1 HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是
A.c(HCN) < c(CN—)
B.c(Na+)= c(CN—)
C.c(HCN)— c(CN—) = c(OH—)
D.c(HCN)+ c(CN—) =" 0.1" mol·L-1
参考答案:D
本题解析:将0.2 mol·L-1 HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,HCN 过量,溶液显碱性说明HCN的电离程度比CN—的水解程度小,c(HCN) >c(CN—),A错;CN—会发生水解,c(Na+)>c(CN—)
B错,根据物料守恒和电荷守恒不能得出C中的等式,C错;D为物料守恒,选D。
考点:盐类水解、弱电解质的电离、溶液中离子浓度大小比较。
本题难度:一般
5、填空题 (1)常温下pH="5" HCl溶液和pH=5的AlCl3溶液中由水电离产生的c (H+) 之比等于 。
(2)写出泡沫灭火器灭火时发生反应的离子方程式 。
(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有 种微粒,各离子浓度从大到小的顺序为 。
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(忽略溶液混合时的体积变化)。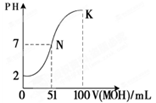
回答下列问题:
①由图中信息可知HA为_______酸(填“强”或“弱”) ② K点对应的溶液中c(M+)+c(MOH)= mol·L-1。
参考答案:(1) 10-4:1或1:104; (2)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3) 7;C(Cl-)>C(H+)>C(Na+)>C(CH3COO-)>C(OH-);(4) ①强 ②0.01
本题解析:(1)常温下pH="5" HCl的溶液,C(H+)=10-5mol/L,C(OH-)= C(H+)(水)=10-9mol/L, pH=5的AlCl3溶液C(H+)(水)=10-5mol/L 。所以二者由水电离产生的c (H+) 之比等于10-9mol/L:10-5mol/L=10-4:1=1:104. (2)泡沫灭火器灭火时发生反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有H2O、CH3COOH、H+、Cl-、CH3COO-、Na+、 OH-七种微粒。HCl+CH3COONa= CH3COOH+NaCl.n(Na+)=0.01mol,n(Cl-)=0.02mol,由于CH3COOH的电离作用大于CH3COO-的水解作用,所以n(CH3COOH)>0.01mol, n(CH3COO-) < 0.01mol.n(H+)>n(OH-).各离子浓度从大到小的顺序为C(Cl-)>C(H+)> C(Na+)>C(CH3COO-)> C(OH-).(4) 100 mL 0.01 mol·L-1HA与51ml的0.02 mol·L-1MOH溶液混合溶液恰好为中性,说明HA为强酸,MOH为弱碱。K点对应的溶液中c(M+)+c(MOH)="(" 0.02 mol/L×0.1L)÷0.2L=0.01mol/L.
考点:考查酸溶液、盐溶液中水的电离、溶液中离子浓度的比较、泡沫灭火器的原理等知识。
本题难度:困难