时间:2017-08-01 02:37:10
1、填空题 已知下列反应:
H2(g)=2H(g) ΔH1=+Q1kJ/mol;O2(g)=2O(g) ΔH2=+Q2kJ/mol
2H(g)+O(g)=H2O(g) ΔH3=-Q3kJ/mol;H2O(g)=H2O(l) ΔH4=-Q4kJ/mol
H2(g)+ 1/2O2(g)=H2O(l);ΔH5=-Q5kJ/mol
试指出Q1、Q2、Q3、Q4、Q5的等量关系:__________________
参考答案:2Q5+2Q1+Q2=2Q3+2Q4
本题解析:
本题难度:一般
2、选择题 已知下列热化学方程式:
Zn(s)+1/2O2(g)=ZnO(s) △H=-351.1 kJ/mol
Hg(l)+1/2O2(g)=HgO(s) △H=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l)的反应热△H为
[? ]
A.-260.4 kJ/mol
B.+260.4 kJ/mol
C.-441.8 kJ/mol
D.+441.8 kJ/mol
参考答案:A
本题解析:
本题难度:一般
3、简答题 实验室模拟合成氨和氨催化氧化的流程如下: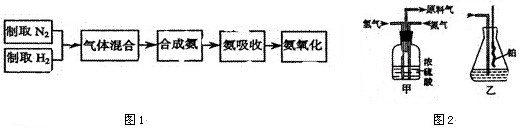
(l)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化钱溶液经加热后反应制取氮气,写出该反应的化学方程式:______.
(2)图中,氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有______.
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨______(“会”或“不会”)发生倒吸,原因是______.
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是______.锥形瓶中还可观察到的现象是:______.
(5)写出乙装置中氨氧化的化学方程式:______.
(6)用CH4催化还原NO2可以消除氮氧化物的污染.例如.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1,
写出CH4还原NO2至N2的热化学方程式______;若用标准状况下4.48LCH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用N2表示),放出的热量为______kJ.
参考答案:(1)根据质量守恒定律及题干信息可知,反应物是NaNO2和NH4Cl,生成物是N2和H2O和NaCl,用观察法配平即可,反应方程式为:NH4Cl+NaNO2?△?.?NaCl+N2↑+2H2O,故答案为:NH4Cl+NaNO2?△?.?NaCl+N2↑+2H2O;
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体,
故答案为:干燥气体,观察气泡速度,控制氢气和氮气的流速;
(3)氨气的混合气体中含有大量的氮气和氢气,均是难溶于水的气体,不会倒吸,
故答案为:不会;混合气体中含有大量难溶于水的氮气和氢气;
(4)氨的氧化反应是一个放热反应,放出的热使铂丝保持红热,生成的一氧化氮与空气中的氧气化合成二氧化氮,二氧化氮是红棕色气体,故答案为:氨的氧化反应是一个放热反应,放出的热使铂丝保持红热;有红棕色气体产生;
(5)氨的催化氧化反应方程式为:4NH3+5O2催化剂.△4NO+6H2O,故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(6)已知①CH4(g)+4N02(g)═4NO(g)+C02(g)+2H20(g)△H=-574kJ?mol-1,
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160kJ?mol-1,
则反应CH4(g)+2N02(g)═N2(g)+C02(g)+2H20(g)等于12(①+②),
根据盖斯定律,所以反应CH4(g)+2N02(g)═N2(g)+C02(g)+2H20(g)△H=12[(-574kJ?mol-1)+(-1160kJ?mol-1)]=-867KJ/mol,反应CH4(g)+2N02(g)═N2(g)+C02(g)+2H20(g)中,1mol甲烷参加反应转移电子数为8mol,所以标准状况下4.48L极0.2molCH4还原NO2至N2整个过程中转移的电子为1.6mol,电子总数为1.6NA,当转移8mol电子,放出的能量为867KJ,所以转移1.6mol电子放出的能量为173.4KJ,
故答案为:CH4(g)+2N02(g)═N2(g)+C02(g)+2H20(g)△H=-867KJ/mol;1.6NA;173.4.
本题解析:
本题难度:一般
4、填空题 已知:2Al (s)+3/2O2(g)=== Al2O3(s) △H= -1 644.3 kJ·mol-1
2Fe (s) +3/2O2(g)=== Fe2O3(s) △H= -815.88 kJ·mol-1 试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式______________________。
参考答案:2Al(s)+Fe2O3(s)==Al2O3(s) +2Fe(s);△H=-828.42 kJ·mol-1
本题解析:
本题难度:一般
5、简答题 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol?CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=______;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+?)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2?
一定条件 |
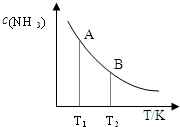
| 时间/min 浓度/mol.L | c?(N2) | c?(H2) | c?(NH3) 0 0.6 1.8 0 3 0.52 x 0.16 6 0.36 1.08 0.48 9 0.36 1.08 0.48 |
参考答案:(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1? ①
? CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2?②
根据盖斯定律得:2CH4(g)+4NO2(g)=2CO2(g)+4H2O(g)+2N2(g)△H1+△H2?
而?1mol?CH4还原NO2至N2,整个过程中放出的热量为867kJ,所以△H1+△H2=-1734kJ?mol-1,则△H2=-1734kJ?mol-1+574kJ?mol-1=-1160?kJ?mol-1,故答案为:-1160kJ?mol-1;?
(2)阴极得电子发生还原反应:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3
(3)①N2 +3H2? ?通电?.一定条件? ?2NH3
起始(mol)? ?1?3? 0
反应(mol)? ?a?3a? ?2a
平衡(mol)?1-a?3-3a? 2a
因混合气体中氨占25%,则?2a(1-a)+(3-3a)+?2a×100%=25%,解得:a=0.4,
N2的转化率为0.4?1?×100%=40%,故N2的转化率为40%;
②平衡常数?KA=C2(NH3)C(N2?)C3(H2)=0.0820.06×0.183,故答案为:0.0820.06×0.183;升高温度平衡向吸热的方向移动,即逆反应方向移动,平衡常数减小,故答案为:>;
③N2的反应速率为V=△C△t=0.083mol?L-1?min-1,而V(H2)=3V(N2)=0.08?mol?L-1?min-1,
故答案为:0.08?mol?L-1?min-1;
③根据表可知第2min是平衡建立过程,反应速率加快,H2的量没有增加,根据外界条件对化学反应速率的影响,可知使用催化剂、升高温度均可,增加H2的浓度是不可,故选:a;
本题解析:
本题难度:一般