时间:2017-08-01 02:37:10
1、选择题 已知:
2Zn(s)+O2(g)=2ZnO(s)△H1=-702.2kJ/mol?
2Hg(s)+O2(g)=2Hg?O(s)△H2=-181.4kJ/mol
Zn(s)+HgO(s)=Hg(s)+ZnO(s)△H3
则△H3的值是( ? )
A.-441.8kJ/mol
B.-254.6kJ/mol
C.-438.9kJ/mol
D.-260.4kJ/mol
参考答案:D
本题解析:
本题难度:一般
2、简答题 氢氧化镁用于制药工业,还是重要的绿色阻燃剂.
I、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2.
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:______.
Ⅱ、已知:
Mg?(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=-441kJ?mol-1
H2O(g)=H2(g)+
| 1 2 |
| 1 2 |
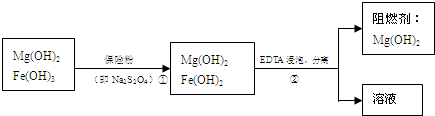
| 精制阻燃剂的条件 | 阻燃剂铁含量 序号 提纯体系温度T/℃ 加入EDTA质量(g) 加入保险粉质量(g) W(Fe)/(10-4g) 1 40 0.05 0.05 7.63 2 40 0.05 0.10 6.83 3 60 0.05 0.10 6.83 4 60 0.10 0.10 6.51 | |||
参考答案:(1)氢氧化镁能和盐酸发生中和反应,生成氯化镁和水,实质是:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(2)①Mg?(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=-441kJ?mol-1
②H2O(g)=H2(g)+12O2(g)△H2=+242kJ?mol-1
③Mg(s)+12O2(g)=MgO(s)△H3=-602kJ?mol-1
根据盖斯定律:反应Mg(OH)2(s)=MgO(s)+H2O(g),可以看成是③+②-①,所以该反应的△H=-602kJ?mol-1
+242kJ?mol-1+441kJ?mol-1=+81kJ?mol-1,故答案为:Mg(OH)2(s)=MgO(s)+H2O(g),△H=+81kJ?mol-1;
(3)氢氧化镁分解会放出大量的热,所以氢氧化镁可以作为阻燃剂,故答案为:氢氧化镁分解会放出大量的热;
(4)EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(0H)2反应,实现氢氧化镁和溶液分离的方法是过滤,
故答案为:过滤;
(5)氧化还原反应6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O中,化合价升高值=化合价降低值=转移电子数=6,即每消耗1mol保险粉(Na2S2O4)时,转移电子6mol,所以消耗0.1mol保险粉(Na2S2O4)时,转移电子0.6mol,个数为0.6NA,
故答案为:0.6NA;
(6)随着EDTA的加入,EDTA将结合Fe2+,如果减少生成物的浓度能使化学平衡向着正反应方向移动,故答案为:Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2?Fe2++2OH-,随着EDTA的加入,EDTA将结合Fe2+,促使平衡向右移动而溶解.
(7)根据表中数据,制取高纯度阻燃剂最佳条件是温度较低、所加EDTA和保险粉质量较多,故选C.
本题解析:
本题难度:一般
3、填空题 发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+67.7 kJ·mol-1; ①
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2= - 534 kJ·mol-1。 ②
试计算1mol肼和二氧化氮完全反应时放出的热量为_______________kJ,写出肼与二氧化氮反应的热化学方程式:________________。
参考答案:567.85 ;2N2H4(g)+2NO2(g)=3N2(g)+ 4H2O(g) △H=-11317kJ·mol-1
本题解析:
本题难度:一般
4、选择题 已知:A(g)+B(g)====C(g) ΔH=ΔH1,D(g)+B(g)====E(g) ΔH=ΔH2,若A和D的混合气体1mol完全与B反应,放热ΔH3,则A和D物质的量之比是
[? ]
A.(ΔH2-ΔH3)∶(ΔH1-ΔH3)
B.(ΔH3-ΔH2)∶(ΔH1-ΔH3)
C.(ΔH3-ΔH2)∶(ΔH 3-ΔH 1)
D.(ΔH 1-ΔH3)∶(ΔH 3-ΔH1)
参考答案:B
本题解析:
本题难度:一般
5、选择题 下面是四个化学反应的热化学方程式:
①C(s)+O2(g)=CO2(g) △H1
②2H2(g) +O2(g) =2H2O(l) △H2
③CH3COOH(l) +2O2(g)=2CO2(g)+2H2O(l) △H3
④2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H4
下列焓变之间的关系正确的是
[? ]
A.2△H1=△H2 - △H3+△H4
B.△H2= 2△H1-△H3+△H4
C.△H3=2△H1 +△H2+△H4
D.△H4= 2△H1+△H2-△H3
参考答案:D
本题解析:
本题难度:一般