时间:2017-08-01 02:35:21
1、简答题 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______.直到因加入一滴盐酸后,溶液由黄色变为橙色,并______为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是______
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示: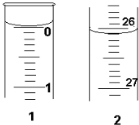
则起始读数为______mL,终点读数为______mL;所用盐酸溶液的体积为______?mL.
(4)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL 滴定前刻度 滴定后刻度 溶液体积/mL 第一次 25.00 0.00 26.11 26.11 第二次 25.00 1.56 30.30 28.74 第三次 25.00 0.22 26.31 26.09 | ||
2、实验题 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答
(1)准确称取4.1g烧碱样品,所用主要仪器是____________________________。
(2)将样品配成250mL待测液,需要的仪器有_________________________________。
(3)取10mL待测液,用______________________量取。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时________手旋转_________式滴定管的玻璃活塞,____________手不停地摇动锥形瓶,两眼注视________________,直到滴定终点。
(5)根据下表数据,计算待测烧碱溶液的浓度:_____________________。 
(6)根据上述各数据,计算烧碱的纯度:__________________________。
3、实验题 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请 填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视__________ 。直到加入一滴盐酸后,溶液由黄色变为橙色,并__________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是 ____(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如下图所示, 则起始读数为____mL,终点读数为____mL;所用盐酸溶液的体积为____mL。
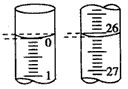
4、简答题 有些化学反应进行时观察不到明显的现象.某兴趣小组为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计如下方案.
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸并不断振荡,同时测定混合溶液的pH,若测得pH逐渐变小且小于7,证明NaOH与稀盐酸发生了中和反应.
(1)用pH试纸测定溶液的pH时,正确的操作是:______.
(2)简述强调“测得的pH小于7”的理由:______.
方案二:在NaOH溶液中滴加几滴酚酞,溶液显红色,再滴加稀盐酸,红色逐渐消失,证明NaOH溶液与稀盐酸发生了中和反应.但该组同学在向NaOH溶液中滴加酚酞时发现氢氧化钠溶液中滴入酚酞后,溶液变成了红色,过了一会儿红色消失.该小组对这种意外现象的原因作如下猜想:
①可能是酚酞被空气中的氧气氧化,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,将配制的氢氧化钠溶液加热,在液面上滴一些植物油,冷却后向溶液中再滴入酚酞.“加热”和“滴入植物油”目的是______.结果表明红色消失与空气中的氧气无关.
(2)为验证猜想②,取一定量的Na2CO3溶液,向其中滴入酚酞,发现溶液呈现红色,得出以下结论:
结论1:说明Na2CO3溶液呈______性;
结论2:说明溶液红色消失与空气中的二氧化碳无关.
(3)通过查阅资料得知:酚酞在氢氧化钠溶液浓度很大时,可能重新褪至无色.请设计实验方案证明红色消失的原因是取用的NaOH溶液浓度过大:实验方法:______,观察到的现象:______.
5、填空题 ①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。 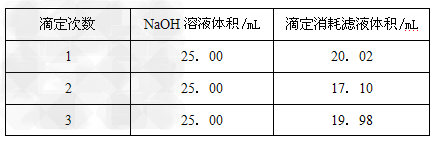
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2)?配制成250mL溶液使用的量具是__________,指示剂还可用____________;
(3)?滴定终点的现象是_______________________。
(4)?滤液中溶质的物质的量浓度为_____________。
(5)?若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。?(填“偏高”、“偏低”或“无影响”)