时间:2017-08-01 02:35:21
1、选择题 以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离SO2(l)+SO2(l)?SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是(? )
A.该滴定反应可以表示为:SO32-+SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
参考答案:C
本题解析:
本题难度:简单
2、简答题 (1)现用物质的量浓度为a?mol/L的标准盐酸去测定V?mL?NaOH溶液的物质的量浓度,请填写下列空白:
酸式滴定管用蒸馏水洗净后,还应该进行的操作是______;图1是酸式滴定管中液面在滴定前后的读数,则c?(NaOH)=______;若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会______(偏高、偏低).
(2)图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用______溶液滴定______溶液;曲线b是用______溶液滴定______溶液;盐酸的物质的量浓度为______mol/L.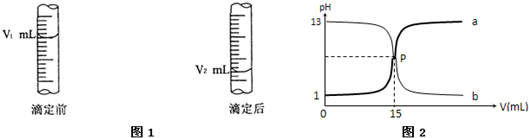
参考答案:(1)滴定管使用前应用盐酸润洗,故答案为:用标准盐酸润洗2-3次;中和滴定中盐酸和NaOH的物质的量相等,(V2-V1)a=c?(NaOH)V,滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故答案为:用标准盐酸润洗2-3次;a(V2-V1)V;偏高;
(2)开始pH=1,由pH=-lgc(H+),则c(HCl)=0.1mol/L,曲线a的pH升高,且pH=1,则为NaOH滴定HCl;曲线b的pH降低,且开始pH=13,则为HCl滴定NaOH,
故答案为:NaOH;HCl;HCl;NaOH;0.1.
本题解析:
本题难度:一般
3、选择题 中和滴定中,眼睛应注视的是
[? ]
A.滴定管内的液面变化
B.液滴滴出的速度
C.滴定管刻度
D.锥形瓶中溶液颜色变化
参考答案:D
本题解析:
本题难度:简单
4、实验题 某兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题进行了如下探究:
【查阅资料】下表是实验室里盐酸、氢氧化钠试剂瓶标签上的部分说明
【实验探究】
(1)配制溶液:甲同学配制100mL 1.5 mol·L-1氢氧化钠溶液,乙同学取20mL 36.5%的盐酸稀释到200mL。甲为了证明氢氧化钠溶液与稀盐酸能发生化学反应,设计并完成了如下图所示的实验。 
X溶液滴入的量一般为__________________,使用酸式滴定管前要检查活塞是否漏水的操作方法是____________________。
(2)乙设计完成了另一个实验,以证明氢氧化钠溶液与盐酸能够发生反应。他在盛有20mL稀盐酸的锥形瓶里,用碱式滴定管滴入氢氧化钠溶液,不断振荡溶液,同时用pH计测定溶液的pH,直到盐酸过量。则在滴定过程中,滴定终点附近的操作是___________________________。
(3)你认为甲、乙两位同学的实验中,_______(填“甲”“乙”或“甲和乙”)的实验能充分证明氢氧化钠与盐酸发生了反应。
(4)丙同学为了测定上述36.5%盐酸的物质的量浓度,进行了如下实验:在锥形瓶中加入已稀释的盐酸等,用碱式滴定管滴入甲配制的氢氧化钠溶液,测定的结果如下表: 
据此通过计算可知实验测定的盐酸浓度与标签说明的浓度相比_________(填“偏高”“偏低”或“相等”)。
参考答案:(1)2~3;滴将活塞关闭,在滴定管内注入一定量的水,记下读数,静置约2 min,并观察液面是否下降,活塞周围及尖嘴处是否漏液,然后将活塞转动180°,再检查一次
(2)测试和记录pH的间隔要小,每加1滴测一次,并记录一次
(3)乙
(4)相等
本题解析:
本题难度:困难
5、实验题 传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
(1)用____(填仪器名称)量取10.00mL食用白醋,在________(填仪器名称)中用水稀释后转移到100mL
_______(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
(2)量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(如左图),向烧杯中滴加浓度为0.1000mol/L的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(如右图)。 
①用滴定管盛氨水前,滴定管要用________润洗2~3次,否则会使测定的醋酸的物质的量浓度_________(填“偏高”或“偏低”)。
②氨水与醋酸反应的离子方程式是_______________。
③食用白醋中醋酸的物质的量浓度是_________________。
参考答案:(1)量筒(或移液管);烧杯;容量瓶
(2)①0.1000mol/L的氨水;偏高;②CH3COOH+NH3·H2O=CH3COO-+NH4++H2O;③1.000mol/L
本题解析:
本题难度:一般