时间:2017-08-01 02:29:12
1、填空题 (7分)(1)在配合物Ni(C O)4和 [Cu(NH3)4]2+,[Fe(SCN)]2+配合物离子中,提供空轨道接受孤对电子的原子或离子分别是:_______________、___________、___?__________。
O)4和 [Cu(NH3)4]2+,[Fe(SCN)]2+配合物离子中,提供空轨道接受孤对电子的原子或离子分别是:_______________、___________、___?__________。
(2)H3O+的空间构型为:___________________________ ,BCl3的空间构型为:___________
,BCl3的空间构型为:___________
(3)按要求写出第二周期非金属元素构成的中性分 子
子 的化学式:(只需写一种)
的化学式:(只需写一种)
平面三角形分子________________,三角锥形分子_________________________。
参考答案:(1)Ni、Cu2+、Fe3+(2)三角锥型、平面正三角形(3)BF3、NF3
本题解析:略
本题难度:一般
2、填空题 Ⅰ.下列说法中正确的是?。
A.SO2和O3、PO43-和ClO4-互为等电子体
B.甲烷分子失去一个H+,形成CH3-,其碳原子的杂化类型发生了改变
C.Ti原子的核外电子排布式为[Ar]3d34s2
D.CS2、H2O、C2H2都是直线形分子
E.CH4、BCl3、CO2都是含有极性键的非极性分子
Ⅱ.立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐?,比较下列原子的第一电离能:Be?B,N?O(填“>”“<”),其原因是?。
(2)如图为立方氮化硼的晶胞,则氮化硼的化学式为?,该晶体中B原子填充N原子的?空隙。若该晶胞的边长为a cm,那么该晶体的密度为?g/cm3(只要求列出算式)。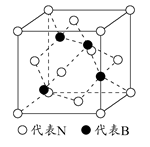
(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因:?。
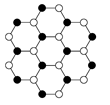
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为?,请画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
参考答案:(Ⅰ)AE
(Ⅱ)(1)增大?>?>? Be原子中2s轨道处于全充满状态,N原子中2p轨道处于半充满状态,是比较稳定的状态,故它们的第一电离能高于两边相邻的原子
(2)BN?四面体?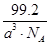
(3)立方氮化硼晶体中氮硼键的键长比金刚石晶体中碳碳键的键长要长,故熔点比金刚石的低
(4)sp2
本题解析:(Ⅰ)甲烷失去氢离子,其杂化类型没有发生变化,Ti的基态原子核外电子排布为[Ar]3d24s2,水是Ⅴ形分子。同一周期元素的第一电离能随着原子序数的增大而逐渐增大,但也有特殊情况,如第二周期:Be>B>N>O,这与Be全充满、N半充满的结构稳定有关。
(Ⅱ)根据立方氮化硼的晶胞结构图可知,该晶胞中含有4个B原子、4个N原子,故氮化硼的分子式为BN。B原子填在氮原子的正四面体结构中,每一个晶胞的体积为a3 cm3,阿伏加德罗常数个晶胞的体积为NA a3 cm3,BN的质量为24.8 g/mol×4mol=99.2 g,BN的密度为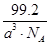 g/cm3。BN熔点比金刚石低的原因与化学键的强度有关,B—N键的键长大于C—C键的键长。立方氮化硼结构和性质与石墨相似,因此B、N原子均采用sp2杂化,在平面结构示意图中两原子交替出现。
g/cm3。BN熔点比金刚石低的原因与化学键的强度有关,B—N键的键长大于C—C键的键长。立方氮化硼结构和性质与石墨相似,因此B、N原子均采用sp2杂化,在平面结构示意图中两原子交替出现。
本题难度:一般
3、填空题 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为________,第一电离能最小的元素是________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式),呈现如此递变规律的原因是___________________。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为________________________________________________g·cm-3(保留两位有效数字)。(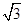 =1.732)
=1.732)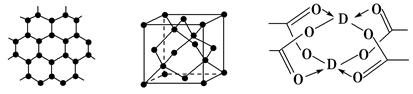
图一 图二 图三
(4)D元素形成的单质,其晶体的堆积模型为________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是________。请写出上述过程的离子方程式:_________________________________________。
参考答案:(1) 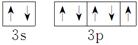 Cu
Cu
(2)HF>HI>HBr>HCl HF分子之间形成氢键使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大
(3)sp2 3.5 (4)面心立方最密堆积 ①②③
(5)首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
本题解析:根据四种元素分别处于第一至第四周期,结合题中信息可确定A、B、C、D四种元素分别为H、C、Cl和Cu。(1)四种元素中电负性最大的是Cl,其基态原子的价电子数为7,价电子排布图为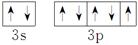 ;结合第一电离能的变化规律,可知Cu的第一电离能最小。(2)卤化氢随着相对分子质量递增,其沸点升高,但HF分子间存在氢键,沸点最高,即沸点由高到低的顺序是HF>HI>HBr>HCl。(3)图一为平面分子,该物质碳原子采取sp2杂化;一个晶胞中含碳原子数为8×
;结合第一电离能的变化规律,可知Cu的第一电离能最小。(2)卤化氢随着相对分子质量递增,其沸点升高,但HF分子间存在氢键,沸点最高,即沸点由高到低的顺序是HF>HI>HBr>HCl。(3)图一为平面分子,该物质碳原子采取sp2杂化;一个晶胞中含碳原子数为8×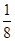 +6×
+6×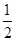 +4=8,该晶胞的密度为
+4=8,该晶胞的密度为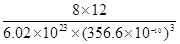 g·cm-3≈3.5 g·cm-3。(4)晶体Cu为面心立方最密堆积,结合图三醋酸铜晶体的局部结构可确定其晶体中含有极性键、非极性键和配位键。(5)硫酸铜溶液中加入氨水会产生蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,据此可写出反应的离子方程式。
g·cm-3≈3.5 g·cm-3。(4)晶体Cu为面心立方最密堆积,结合图三醋酸铜晶体的局部结构可确定其晶体中含有极性键、非极性键和配位键。(5)硫酸铜溶液中加入氨水会产生蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,据此可写出反应的离子方程式。
本题难度:一般
4、填空题 如图所示每条折线表示周期表ⅣA~ⅦA族中某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是____________,b点代表的是__________。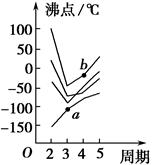
参考答案:SiH4? H2Se
本题解析:第二周期ⅣA~ⅦA族元素分别是C、N、O、F,其氢化物的沸点由高到低的顺序是
H2O>HF>NH3>CH4,因此,由上至下4条折线分别代表ⅥA、ⅦA、ⅤA、ⅣA族元素的氢化物的沸点变化。那么,b点代表的物质是H2Se,a点代表的物质是SiH4。
本题难度:一般
5、选择题 下列化学用语错误的为( )
A.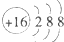
B.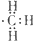
C.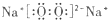
D.
参考答案:A.表示硫离子的结构示意图,故A正确;
B.甲基是电中性基团,碳原子与氢原子之间形成对共用电子对,碳原子含有1个单电子,甲基电子式为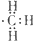 ,故B正确;
,故B正确;
C.过氧化钠属于离子化合物,由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成1对共用电子对,电子式为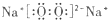 ,故C正确;
,故C正确;
D.氮气分子中氮原子之间形成3对共用电子对,氮原子含有1对孤对电子对,电子式为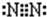 ,故D错误;
,故D错误;
故选D.
本题解析:
本题难度:简单