时间:2017-08-01 01:42:49
1、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)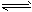 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
_________移动(填“向左”、“向右”或“不”);使用催化剂,反应的△H________ (填“增大”、“减小”或“不改变”)。
(2)已知:
O2(g) = O2+(g)+e- △H1=1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) △H2=-771.1 kJ·mol-1
O2PtF6(s)=O2+(g)+PtF6-(g) △H3=482.2 kJ·mol-1
则反应O2(g)+PtF6(g) =O2PtF6(s)的△H=_____________kJ·mol-1。
(3)已知:25℃时Ksp=1.8×10-11,Ksp=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和
CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为
________________。
(4)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-)。则溶液显_____性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
2、填空题 (9分)完成以下小题:
(1)已知NaHSO3溶液显酸性,则溶液中各离子浓度从大到小的顺序是?。
(2)25℃时,向pH=4的NaHSO4溶液中,逐滴加入pH=9的Ba(OH)2溶液至中性,则该过程的离子反应方程式?;已知25℃时BaSO4的Ksp=1.0×10-10,则以上过程中??沉淀生成(填“有” 或“无”)。
(3)某温度下,0.1 mol·L-1Na2CO3溶液中c(Na+)∕c(CO32-)=20/9,其原因是?;现往Na2CO3溶液中通入一定量的CO2后,c(Na+)∕c(CO32-)=5∕2,其原因是?。(用离子方程式和必要的文字说明)
3、选择题 已知存25°时几种物质的0. 1mol.L-1溶液的电离度如下表: 
将足量锌粉分别放入等体积且氢离子浓度相等的下列溶液中:
①H2SO4溶液;②HCl溶液;③CH3COOH溶液;④NaHSO4溶液。
放出氢气的量的关系正确的是(假设浓度对电离度的影响忽略不计)
[? ]
A.①=②=④>③
B.②>④>①>③
C.③>①>④>②
D.③>④>①>②
4、选择题 用蒸馏水逐渐稀释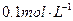 的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是(?)
的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是(?)
A.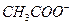 的物质的量浓度
的物质的量浓度
B.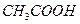 的物质的量浓度
的物质的量浓度
C.H+的物质的量浓度
D.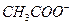 和H+的物质的量
和H+的物质的量
5、填空题 (1)今有①盐酸 ②醋酸的两种溶液,在体积相同,物质的量浓度均为0.1 mol/L时,H+物质的量浓度:
①_______②(填“>”、“<”或“=”,下同),pH:①_______②;中和等量NaOH时消耗的体积:
①_______②;与足量的Zn反应生成H2的物质的量:①_______②。
(2)今有①醋酸 ②硫酸的两种溶液,在体积相同、pH均为2时,溶质物质的量浓度:①_______②;分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积:①_______②;加水稀释到pH均为3时,所加水的体积:①_______②。