时间:2017-08-01 01:42:04
1、计算题 过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用。它与二氧化碳反应的化学方程式为:2Na2O2 + 2CO2=2Na2CO3 + O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置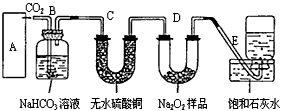
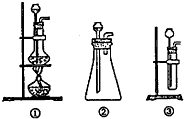
(1)A中制取CO2的装置,应从上右图①、②、③中选哪个:_____________。B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现什么现象?_____________________。为了检验E中收集到的气体,在取出集气瓶后,用__________的木条伸入集气瓶内,木条会出现_______________________。
(2)若E中石灰水出现轻微浑浊,请说明原因:_______________________。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,又知氧气的密度为1.43克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值________(大或小),相差约________毫升(取整数值,所用数据均在标准状况下测定),这可能是由于__________________________。
(4)你认为上述A--E的实验装置中,E部分是否安全、合理?______________;E是否需要改进,若需要改进,应改为下图中的_________(填甲、乙、丙、丁)。 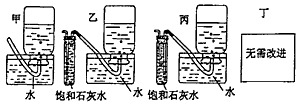
2、实验题 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称摩尔盐。某兴趣小组制备硫酸亚铁铵的实验方案示意图如下:
已知:H2S、PH3为有毒气体,都能被CuSO4溶液吸收除去。请回答下列问题:?
(1)实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑。从以下仪器中选择组装,完成该操作必需的仪器有________?(填编号)。
①铁架台?②玻璃棒?③广口瓶?④石棉网?⑤烧杯?⑥漏斗?⑦酒精灯
(2)方案A中FeSO4溶液的制备:将处理好的铁屑放入锥形瓶,加入过量的3?mol/LH2SO4溶液,加热至充分反应为止。趁热过滤,收集滤液和洗涤液。下右图装置中方框内选择更适合用于实验方案A的装置是__________?(填“甲”或“乙”)。 
(3)方案A中废铁屑中含氧化铁,无需在制备前除去,理由是__________________(用离子方程式回答),用无水乙醇洗涤晶体的原因是___________________。
(4)实验方案B中FeSO4溶液的制备:用“五水硫酸铜结晶水的测定”实验中的废弃物--无水硫酸铜粉末代替稀硫酸与铁屑反应制备硫酸亚铁。当用无水硫酸铜配制的溶液由蓝色完全变为浅绿色时停止反应,过滤,收集滤液即得硫酸亚铁溶液。此方案的优点有_________?(填编号)。
a.?充分利用了实验室废弃物--硫酸铜粉末,避免了药品浪费,又回收了金属铜,实现了变废为宝
b.?避免了有毒气体的排放对环境造成的污染
c.?原子利用率达到100%
d.?避免了在加热中Fe2+被氧化成Fe3+,?有利于产品质量等级的提高,并节约了能源
(5)产品中Fe3+杂质的定量分析
①配制Fe3+浓度为1.0mg/mL的标准溶液100mL。称取_________mg高纯度的硫酸铁铵(NH4)Fe(SO4)2·12H2O,加?2.00?mL经处理的去离子水,振荡溶解后,加入2mol/L?HBr?溶液?l?m?L和?l?mol/L?KSCN溶液0.5?mL,加水制成100?mL溶液。配制过程中必须用到的定量仪器为________(选填编号)。
a.?精确度为0.001g的电子天平?
b.精确度为0.1mg的电子天平?
c.100?mL容量瓶?
d.酸式滴定管?
e.10mL量筒
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液。分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。 
③取该兴趣小组所得的硫酸亚铁铵产品,按步骤①配得产品溶液10mL,稀释至100?mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.490、0.510,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_________mg/L。
3、实验题 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl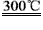 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅已知SiHCl3,能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点--84.7℃),提纯SiHCl3采用的方法为___________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去): 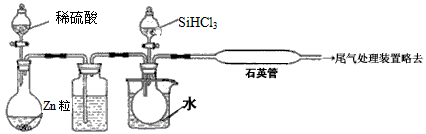
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是___________。
②反应一段时间后,装置D中观察到的现象是______________________,装置D不能采用普通玻璃管的原因是___________,装置D中发生反应的化学方程式为______________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂
(填写字母代号)是_________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
4、选择题 下列对于制备乙酸乙酯的实验叙述错误的是( ? )
A.药品的加入顺序是先加入乙醇,然后边振荡边慢慢加入浓硫酸和乙酸
B.收集乙酸乙酯时导管口应在液面以上
C.收集乙酸乙酯的试管中加入饱和碳酸钠溶液,可以降低乙酸乙酯在水中的溶解度
D.可用分液操作对产物进行分离提纯,分离时乙酸乙酯从分液漏斗下口流出
5、实验题 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:C2H5-OH+HBr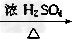 C2H5Br+H2O,已知反应物的用量为:0.30?mol?NaBr(s)、0.25?mol?C2H5OH(密度为0.80?g·cm-3)、36?mL浓H2SO4(质量分数为98%,密度为1.84?g·mL-1)、25?mL水。试回答下列问题。
C2H5Br+H2O,已知反应物的用量为:0.30?mol?NaBr(s)、0.25?mol?C2H5OH(密度为0.80?g·cm-3)、36?mL浓H2SO4(质量分数为98%,密度为1.84?g·mL-1)、25?mL水。试回答下列问题。 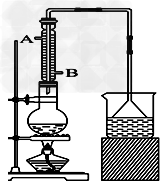
(1)该实验中漏斗的作用是什么?___________________。 ?
(2)反应装置中的烧瓶应选择下列哪种规格最合适_______
A.50?mL?B.100?mL?C.150?mL?D.250?mL
(3)冷凝管中的冷凝水的流向应是________
A.?A进B出?B.?B进A出?C.?从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是用_______洗涤后分液。
A、浓NaOH溶液?B、Na2SO3溶液?C、CCl4?D、水
(5)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:__________________________。