时间:2017-08-01 01:37:29
1、选择题 下列有关实验的说法正确的是( )
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液一定有CO32-
参考答案:A、金属Al既能与酸反应又能与碱反应,而铁不溶于碱,故可用来分离该两种金属,故A正确;
B、瓷坩埚中含有二氧化硅,在加热条件下能与氢氧化钠反应而导致坩埚炸裂,故B错误;
C、制备Fe(OH)3胶体通常的做法是在沸水中滴加饱和的氯化铁溶液,至溶液呈红褐色时停止加热,故C错误;
D、能与盐酸反应产生使澄清石灰水变浑浊的气体的溶液不一定是碳酸盐,也可能为碳酸氢盐溶液或亚硫酸盐溶液,故D错误.
故选A.
本题解析:
本题难度:一般
2、选择题 将amol钠和amol铝一同投入到水中,所得溶液的密度为dg/ml,则该溶液中溶质的质量百分含量为(?)
A 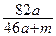 %? B
%? B 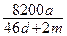 %? C
%? C 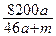 %? D
%? D 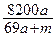 %
%
参考答案:C
本题解析:略
本题难度:简单
3、计算题 准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4
溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示。求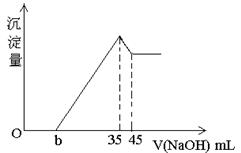
(1)硫酸溶液的物质的量浓度。
(2)若b=2.3,求铝土矿中SiO2的质量分数。
参考答案:(1)1.75mol/L? (2)3%
本题解析:略
本题难度:一般
4、填空题 铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: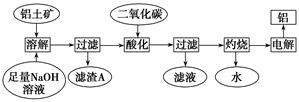
已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(1)?写出向铝土矿中加入足量氢氧化钠溶液操作中发生反应的离子方程式:__________________________;_____________________________。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是:_________。
(3)若将铝溶解,下列试剂中最好选用________(填编号)。理由是_________________。
A.浓硫酸
B.稀硫酸
C.稀硝酸
D.浓硝酸
参考答案:(1)Al2O3+2OH-===2AlO+H2O
SiO2+2OH-===SiO+H2O
(2)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3
(3) B 铝与浓硫酸、浓硝酸在常温下发生钝化;稀硝酸与铝会产生NO气体,污染空气。
本题解析:(1)铝土矿主要成份是Al2O3还有少量Si02,加入足量氢氧化钠溶液后发生如下反应:
?Al2O3+2OH-===2AlO+H2O ; SiO2+2OH-===SiO+H2O; Fe2O3不与氢氧化钠溶液发生反应。
(2)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3
(3)浓硫酸、浓硝酸均能使铝发生钝化,而稀硝酸与铝会产生NO气体,污染空气,因而最好选B稀硫酸。
点评:铝是历年高考的重点和难点,注意加强学习铝的化学性质和化学实验。
本题难度:一般
5、填空题
SiO2属于酸性氧化物,实验室里盛放碱液的玻璃试剂瓶不能用玻璃塞,而常用橡皮塞是因为(用离子方程式表示)_________________________; 玻璃瓶也不能盛装氢氟酸是因为(用化学方程式表示)
_____________________。铝制餐具不宜长时间存放碱性食物的原因是(用离子方程式表示)
?________________________。
参考答案:2OH-+SiO2==SiO32-+H2O; SiO2+4HF==SiF4↑ +2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑
本题解析:
本题难度:一般