时间:2017-08-01 01:37:29
1、选择题 镁粉在焰火、闪光粉、鞭炮的制造中是不可少的原料。工业上制造镁粉是将镁蒸气在某气体中冷却。下列气体:①空气;②二氧化碳;③氩气;④氢气;⑤氮气中可作冷却气体的是(?)
A.①②
B.②③
C.③④
D.④⑤
参考答案:C
本题解析:镁粉在高温下可以和氧气、氮气、二氧化碳气体、氯气等反应,所以不能在这些气体中冷却。
本题难度:一般
2、填空题 (3分)取两等份铝粉,第一份加入250 mL 2 mol·L-1的盐酸,第二份加入400 mL2mol·L-1的烧碱。若同温同压下放出气体体积之比为5:6,则加入的铝粉每份质量为?。
参考答案:5.4g
本题解析:由方程式可知:①2Al+6H+=2Al3++3H2↑?②2Al+2OH-+2H2O=2AlO2-+3H2↑
当铝均不足时,所产生气体的体积比为1:1,当铝均过量时,所产生气体的体积比为1:3,而本题所得气体之比为1:1.2,故铝与酸反应时,酸不足,而与碱反应时,铝不足
故由①可知,250 mL 2 mol·L-1的盐酸生成的气体为0.25×2/2=0.25mol,进而可计算出由②产生的氢气为0.25×6/5=0.3mol,对应的铝粉的质量为:0.2×27=5.4g
本题难度:一般
3、选择题 1 L某混合溶液中,溶质X、Y的浓度都为0.1 mol/L,向混合溶液中滴加某溶液Z(0.1 mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X、Y、Z分别是(?)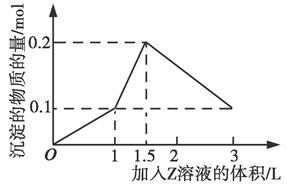
A.AlCl3、FeCl3、NaOH
B.AlCl3、MgCl2、NaOH
C.NaAlO2、Ba(OH)2、H2SO4
D.NaAlO2、BaCl2、H2SO4
参考答案:C
本题解析:若X、Y、Z分别为AlCl3、FeCl3、NaOH,则沉淀的量在加入6 L NaOH时才能达到最大值0.2 mol,A错;若X、Y、Z分别为AlCl3、MgCl2、NaOH,则沉淀的量在加入5 L NaOH时达到最大值0.2 mol,B错;若X、Y、Z分别为NaAlO2、Ba(OH)2、H2SO4,滴加硫酸时先与Ba (OH)2反应,生成BaSO4沉淀和水,然后和NaAlO2依次发生反应:AlO2-+H++H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,C正确;若X、Y、Z分别为NaAlO2、BaCl2、H2SO4,起始时即生成BaSO4沉淀和Al(OH)3沉淀,结合反应方程式知,当加入0.5 L H2SO4时,AlO2-完全反应,生成0.1 mol Al(OH)3沉淀和0.5 mol BaSO4沉淀,继续加入H2SO4,生成BaSO4沉淀的同时Al(OH)3又溶解,故沉淀的最大值不可能为0.2 mol,D错
点拨:本题考查元素化合物知识,考查考生的分析、理解能力。难度中等。
本题难度:一般
4、计算题 由铝和某种金属A组成的混合物,将它分成二等份,一份放入过量的盐酸中,混合物完全溶解,放出H2共12.32L(标准状况),溶液质量增加了9.7g,另一份放入过量烧碱溶液中,充分反应后放出H2共8.96L(标准状况),溶液质量增加了6.4g,而某金属A不反应,试推断未知金属A。
参考答案:A∶Mg
本题解析:定量确定元素种类,通常采用计算原子量与化合价的比值,然后再讨论确定的方法。设A金属的原子量为M,化合价为n,则:
2Al+6HCl=2AlCl3+3H2↑?①
2Al+2NaOH+2H2O=2NaAlO2+3H2↑?②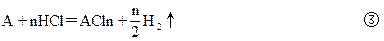
比较①、②、③可知:A与盐酸反应放出的氢气应为: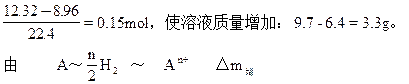
n? M? (M-n)
0.15×2? 3.3
得? 0.3(M-n)= 3.3n即? M=12n
讨论:当 n=+1时, M=12(无此种金属)
当 n=+2时, M= 24(Mg)
当n=+3时,M=36(无此种金属)
故符合题意的只能是镁。
本题难度:一般
5、选择题 熔化氢氧化钾固体应选用的仪器是(?)
A.瓷坩埚
B.石英坩埚
C.氧化铝坩埚
D.铁坩埚
参考答案:D
本题解析:瓷坩埚和石英坩埚的主要成分都含有酸性氧化物SiO2,SiO2能与强碱反应,氧化铝坩埚由氧化铝构成,能与强碱反应,只有铁不会与碱反应。
本题难度:简单