时间:2017-08-01 01:04:42
1、选择题 短周期元素中,原子最外电子层只有1个或2个电子的元素
[? ]
A.是非金属元素
B.是稀有气体元素
C.是金属元素
D.无法确认为哪一类元素
参考答案:D
本题解析:
本题难度:简单
2、选择题 一个电子排布为1s22s22p63s23p1的元素最可能的价态是
A.+1
B.+2
C.+3
D.-1
参考答案:C
本题解析:根据电子排布可知,该元素是铝,最外层电子含有3个,所以化合价是+3价,答案选C。
本题难度:一般
3、推断题 【二选一—选修3:物质结构与性质】
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为?____________________。
(2)关于B2A2的下列说法中正确的是?________________。
A.B2A2中的所有原子都满足8电子结构?
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子?
D.B2A2分子中的B-A键属于s—pσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是?________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因____________
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中?Y含有_____________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相?等,则M的电子式为_____________?,N的结构式为______________。
(6)E的氢化物的价层电子对互斥理论模型为?_______,E?原子的杂化方式为?_________杂化。
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为_____________。 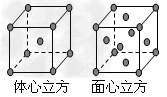
参考答案:(1)3d64s2;?
(2)CD
(3)直线型?
(4)C元素原子的最外层电子的p轨道处于半充满状态,能量低,较稳定,失去第一个电子需要的能量较B、D多?
(5)极性键、非极性键 ;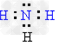 ?;
?;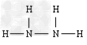
(6)四面体形;sp3;?
(7)2b3:a3 ;3:2
本题解析:
本题难度:一般
4、选择题 下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 浓硝酸在光照下颜色变黄 | 浓硝酸具有不稳定性 |
| B | 浓硫酸具有酸性和吸水性 | 浓硫酸可使PH试纸先变红后变黑 |
| C | Cl2和SO2均有漂白性 | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
| D | C的还原性小于Si | 可用焦炭和石英在高温下反应制取粗硅和CO |
参考答案:A
本题解析:A、浓硝酸见光易分解,生成二氧化氮溶于硝酸使溶液变黄,正确;B、浓硫酸可使PH试纸先变红后变黑,表明浓硫酸具有酸性和脱水性,错误;C、Cl2和SO2均可使含有酚酞的NaOH溶液褪色,但褪色原理不同,前者是强氧化性,后者是漂白性,错误;D、C的还原性大于Si,之所以可用焦炭和石英在高温下反应制取粗硅和CO,是因为CO为气体,生成物浓度减小,使反应一直正向进行,错误,答案选A。
本题难度:一般
5、选择题 下列各项 操作中发生先沉淀后溶解现象的是
操作中发生先沉淀后溶解现象的是
①向饱和碳酸钠溶液中通入过量的CO2? ②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2? ④向石灰水中通入过量CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A.①②④
B.②③⑤
C.②④
D.①③⑤
参考答案:C
本题解析:略
本题难度:简单