时间:2017-08-01 00:27:38
1、实验题 某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大.小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌器、量筒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,实验尚缺少的玻璃用品是 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 _________。
(3)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热△H ( kJ·mol-1) | ||||
| t1 | t2 | |||||
| | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | | |
| ② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ | | |
参考答案:(1)温度计(1分)(2)否(1分);金属易导热,热量散失导致误差大。(2分)
(3)①-56.8(或-56.85)KJ/mol(3分)
②NaOH (aq) + HCl(aq) =" NaCl(aq)" + H2O(l) △H=-56.8KJ/mol(用离子方程式也可)(3分)
(4)无 、 有(各1分)
本题解析:金属的导热系数大于玻璃,造成热量散失,误差大;多次测量,温度取平均值23.4℃,m(HCl)=m(NaOH)=50g,50mL0.55mol·L-1NaOH与50mL.0.5mol·L-1HCl发生中和反应时放出的热量为:Q=Cm(t2 -t1)= 4.18KJ·℃-1· Kg-1×0.1kg×(23.4-20)℃=1.42 KJ,生成1mol水时的反应热为:△H=-1.42 KJ÷0.025mol="-56.8" KJ/mol。中和热是指在稀溶液中,酸跟碱发生中和反应生成1 mol液态水时所释放的热量。KOH与NaOH同为强碱,故对测定结果无影响;醋酸为弱电解质,溶于水发生电离,放出的热量较小。
考点:中和热的测定
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验、化学仪器的相关知识的积累。难度较大。
本题难度:一般
2、选择题 已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1①
2H2(g)+O2(g)===2H2O(g) ΔH=-Q2 ② H2O(g)===H2O(l) ΔH=-Q3③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2
B.4Q1+Q2+10Q3
C.4Q1+2Q2
D.4Q1+0.5Q2+9Q3
参考答案:D
本题解析:混合气的物质的量是112L÷22.4L/mol=5mol,其中甲烷是4mol,氢气是1mol。在常温下水是液态,所以反应中放出的热量是4Q1+8Q3+0.5Q2+Q3=4Q1+0.5Q2+9Q3,答案选D。
考点:考查反应热的有关计算
点评:该题是基础性试题的考查,难度不大。该题的关键是明确反应热的含义以及影响因素,特别是本题中水的状态是液态,需要进行转换,有利于培养学生的逻辑推理能力,提高学生灵活应变能力。
本题难度:简单
3、填空题 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。
请认真观察下图,然后回答问题。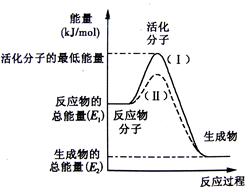
(1)图中所示反应是 (填“吸热”或“放热”)反应,引发该反应时 (填“需要”或“不需要”)加热,该反应的热效应的绝对值为
(用含E1、E2的代数式表示)。
(2)已知反应:H2(g)+1/2 O2(g)=H2O(g)的热效应为为241.8 kJ·mol-1,则其逆反应的活化能为_____kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是 。
参考答案:(1)放热;需要,|E1-E2|;(2)409;(3)使用催化剂。
本题解析:(1)图中所示反应物能量关于生成物能量,故反应是放热反应,因为活化分子能量高于反应物,故引发该反应时需要加热,该反应的热效应的绝对值为|E1-E2|或|E2-E1|;
(2)已知反应:H2(g)+1/2 O2(g)=H2O(g)的热效应为为241.8 kJ·mol-1,则其逆反应H2O(g)=H2(g)+1/2 O2(g)的活化能为反应热的绝对值+正反应的活化能kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,加入了催化剂,活化能大大降低,活化分子百分数增多,反应速率加快。
考点:活化分子理论图像解说。
本题难度:一般
4、选择题 试判断下列物质能否溶于水,能溶于水的组合是(? )
①葡萄糖?②己醛?③硬脂酸?④硬脂酸钠?⑤硬脂酸镁?⑥乙二酸
⑦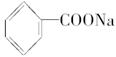 ?⑧
?⑧
⑨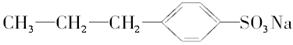
⑩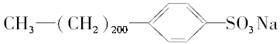
A.①④⑥⑦⑨
B.全溶
C.除⑤⑧外全溶
D.①④⑥⑦
参考答案:A
本题解析:—OH、—COOH、—CHO都是亲水基,但较—COO-、—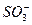 。①⑥中相当于每个C原子上都有亲水基,故易溶于水。而②中只有一个弱的亲水基,而余下的5个C均为憎水基,故②不溶于水。
。①⑥中相当于每个C原子上都有亲水基,故易溶于水。而②中只有一个弱的亲水基,而余下的5个C均为憎水基,故②不溶于水。
⑧中苯酚溶解度不大,加上3个憎水的溴原子后,更加不易溶解于水中,⑤中的硬脂酸镁是沉淀,⑦⑨⑩和④相比,⑦⑨憎水基小,憎水性差,可溶于水,而⑩由于憎水基太大,难溶于水。
本题难度:一般
5、选择题 在反应C(s)+CO2(g)=2CO(g)中,能使反应速率加快的是?
①增大压强?②升高温度?③将C粉碎?④通CO2气体?⑤加入足量木炭粉
A.①②③
B.①②④
C.①②③④
D.全部
参考答案:C
本题解析:试题分析:加快反应速率,可从影响化学反应速率的因素思考,可通过升高温度、有气体参加的反应可增大压强、增大固体的表面积以及增大反应物的浓度等。
①反应有气体参加,增大压强,反应物的浓度增大,反应速率增大,故①正确;
②升高温度,反应速率增大,故②正确;
③将C粉碎,固体表面积增大,反应速率增大,故③正确;
④通CO2气体,反应物的浓度增大,反应速率增大,故④正确;
⑤加入足量木炭粉,碳是固体,改变固体的质量,反应速率不变,故⑤错误,答案选C。
考点:考查影响化学反应速率的因素
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题针对性强,主要是考查学生对反应速率含义以及影响反应速率因素的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力的培养。答题时注意影响化学反应速率的因素和影响原因,注重常见相关基础知识的积累、归纳和总结。
本题难度:一般