时间:2017-08-01 00:27:38
1、选择题 科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的.已知在25℃,105 Pa时,1 molC(石墨)完全燃烧生成CO2气体,放热393.5 kJ,1 molCO完全燃烧生成CO2气体放热283.0 kJ,下列说法正确的是
A.在25℃,105 Pa时,C(石墨)燃烧生成CO气体的热化学方程式是:2C(石墨)+O2(气)=2CO(气);ΔH=-110.5 kJ/mol
B.C(石墨)不完全燃烧,生成CO2和CO混合气体时,放热283.0 kJ
C.C(石墨)和CO2(气)反应生成CO(气)的反应是吸热反应
D.如果金刚石的燃烧热大于石墨的燃烧热,则可以断定从石墨转变为金刚石的变化需要放热.
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列说法正确的是
A.甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g)△H=" -890.3" kJ/mol
B.500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: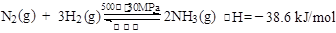
C.已知:2CO(g)+O2(g) ===2CO2(g)ΔH=" -566" kJ/mol,下图可表示由CO生成CO2的反应过程和能量关系
D.已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F 、S-F键需吸收的能量分别为160 kJ、330 kJ。已知1个 SF6(g)分子中含有6条S-F键。则:S(s)+3F2(g) ===SF6(g) △H=-1220 kJ/mol
参考答案:D
本题解析:A.甲烷的标准燃烧热生成的产物必须是液态水,故错误;B、0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故错误;C.已知:2CO(g)+O2(g) ===2CO2(g)?ΔH=" -566" kJ/mol,右图可表示由1molCO生成CO2的反应过程和能量关系,而该方程式表示的是2mol参加的反应,故错误;D、根据反应热等于反应物物键能之各减去生成物的键能之各,可求得是正确的。
本题难度:一般
3、选择题 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体——黑磷,其转化过程中能量变化如图所示。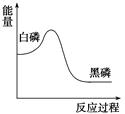
下列叙述中正确的是
A.黑磷比白磷稳定
B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
参考答案:A
本题解析:由图所示,白磷的能量高黑磷的能量低,能量越低越稳定,故黑磷稳定,A正确;黑磷和白磷均是由磷元素组成的不同的单质,互为同素异形体,而同分异构体是分子式相同,结构不同的物质一般指的是有机物,B错误;白磷和黑磷均是单质,化合价为零价,为发生氧化还原反应,C错误;白磷的能量高转化成能量低的黑磷是放热反应,D错误,答案选A.
考点:同素异形体
本题难度:一般
4、填空题 (12分)工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)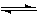 CH3OH(g)?ΔH=-a kJ·mol-1
CH3OH(g)?ΔH=-a kJ·mol-1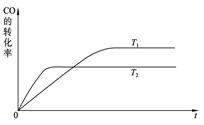
(1)上图是该反应在不同温度下CO的转化率随时间变化的曲线。
①a __0(填“>” “<” “=”)。
②下列说法正确的是_?_(填序号)。
a.1mol CO(g)和2mol H2(g)所具有的能量小于1mol CH3OH(g)所具有的能量
b.将1mol CO(g)和2mol H2(g)置于一密闭容器中充分反应后放出a KJ的热量
c.升高温度,平衡向逆反应移动,上述热化学方程式中的a值将减小
d.如将一定量CO(g)?和H2(g)置于某密闭容器中充分反应后放热aKJ,则此过程中有1molCO(g)被还原
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示: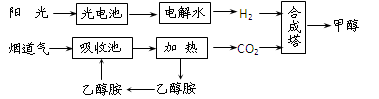
①该合成路线对于环境保护的价值在于_?_。
②15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2
吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
?。
(3)甲醇燃料电池的工作原理如下左图所示。该电池工作时,c口通入的物质发生的电极
反应式为:_?_。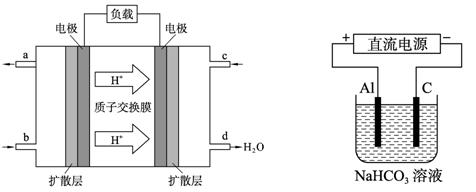
(4)以上述电池做电源,用上右图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_?。
参考答案:(1)① >(2分)?②d(2分)
(2)①有利于防止温室效应(2分)
②HOCH2CH2NH2?+?H2O HOCH2CH2NH3++?OH-(2分)
HOCH2CH2NH3++?OH-(2分)
(3) O2+4e-+4H+ =2H2O(2分);?
(4) Al-3e-= Al3+(1分)? Al3++3HCO3- = Al(OH)3↓+3CO2↑(2分)
或Al-3e-+3HCO3- = Al(OH)3↓+3CO2↑(2分)
本题解析:考查外界条件对平衡的影响以及电化学的应用等。
(1)根据图像可知,温度为T2的曲线先达到平衡状态,所以T2大于T1。随着温度的升高,反应物的转化率是降低的,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,a大于0;反应放热,说明反应物的总能量大于生成物的总能量,a不正确。反应是可逆反应,1mol CO(g)和2mol H2(g)不可能生成1mol甲醇,所以放出的热量要小于akJ,b不正确。反应热与物质前面的化学计量数有关,与平衡的移动方向无关,c不正确。所以选项d是正确的。
(2)根据转化可知生成的CO2用来合成甲醇,所以有利于可知温室效应;根据乙酸胺的结构简式可知,分子中的氨基可以结合水电离出的氢离子,从而破坏水的电离平衡,使溶液中OH-浓度大于氢离子浓度,溶液显碱性。
(3)原电池中负极是失去电子的,甲醇在反应中是还原剂失去电子被氧化,因此甲醇在负极通入。根据燃料电池的结构可判断氢离子向右侧移动,所以右侧是正极,左侧电极是负极。因此氧气在右侧通入,所以c处的电极反应式为O2+4e-+4H+ =2H2O。
(4)根据电解池的结构可知,铝是阳极,失去电子生成铝离子进入溶液中。由于电解质是碳酸氢钠溶液,所以生成的铝离子和碳酸氢钠水解相互促进,从而生成氢氧化铝沉淀。
本题难度:一般
5、选择题 在298K、100kPa时,已知: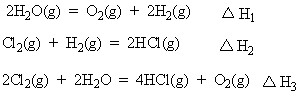
则
参考答案:
本题解析:
本题难度:简单