时间:2017-08-01 00:19:38
1、选择题 在298K、100kPa时,已知: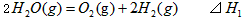
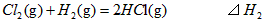
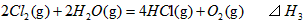
则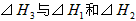 间的关系正确的是
间的关系正确的是
[? ]
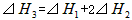
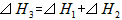
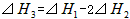
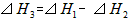 ?
? 参考答案:A
本题解析:
本题难度:一般
2、选择题 已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
4P(红,s)+5O2(g)===2P2O5(s) ΔH1
4P(白,s)+5O2(g)===2P2O5(s) ΔH2
则ΔH1与ΔH2的关系正确的是
[? ]
A.ΔH1=ΔH2
B.ΔH1>ΔH2
C.ΔH1<ΔH2
D.无法确定
参考答案:B
本题解析:
本题难度:一般
3、选择题 如下图所示,△H1=-393.5?kJ·mol-1,△H2=-395.4?kJ·mol-1,下列说法或表示式正确的是 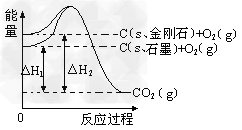
[? ]
A.?C(s、石墨)==?C(s、金刚石)? △H=?+1.9?kJ·mol-1
B.?石墨和金刚石的转化是物理变化
C.?石墨的稳定性强于金刚石
D.?1?mol石墨的总键能比1?mol金刚石的总键能小1.9?kJ
参考答案:AC
本题解析:
本题难度:一般
4、填空题 煤燃烧的反应热可通过以下两个途径来利用:
Ⅰ.利用煤在充足的空气中直接燃烧产生的反应热;
Ⅱ.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
Ⅰ. C(s)+O2(g)====CO2(g);△H=E1 ①
Ⅱ. C(s)+H2O(g)====CO(g)+H2(g);△H=E2 ②
H2(g)+1/2O2(g)====H2O(g);△H=E3 ③
CO(g)+1/2O2(g)====CO2(g);△H=E4 ④
请填写下列空白:
(1)途径Ⅱ与途径Ⅰ相比有较多的优点,即____________;
(2)在上述四个热化学方程式中, ________(填编号)反应的△H>0;
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量正确的关系是(填序号)_____;
A.Ⅰ比Ⅱ多 B.Ⅰ比Ⅱ少 C.Ⅰ与Ⅱ在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为________________。
参考答案:(1)煤的利用率高;变为气体燃料后运输方便;燃烧充分
(2)②
(3)C
(4)E1=E2+E3+E4
本题解析:
本题难度:一般
5、简答题 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______;
(2)某科研小组研究在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果如图2所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1______T2(填“>”、“<”、“=”或“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______(填字母标号),
③在起始体系中加入N2的物质的量为______mol时,反应后氨的百分含量最大.若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=______;
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3?4NO2(g)+O2△H>0下表为反应在某温度下的部分实验数据则50s内NO2的平均生成速率为______
| V/s | 0 | 50 | 100 c(N2O3)/mol?L-1 5.00 3.52 2.48 |
参考答案:(1)17g氨气经催化氧化完全生成一氧化氮气体和水蒸气的焓变=14(180.5kJ?mol-1×2+92.4kJ?mol-1×2-483.6×3)=226.3?kJ?mol-1,故答案为:226.3?kJ;?
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,故答案为:<;
?②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c;
?③当氮气和氢气的物质的量之比为1:3达平衡状态时,氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为n3,当n=3mol反应达到平衡时,H2的转化率为60%,故起始氮气浓度为1mol/l,变化的氢气浓度为1.8mol/l,变化的氮气浓度为0.6mol/l,平衡时氮气、氢气、氨气的浓度分别是0.4mol/l、1.2mol/l、1.2mol/l,据k=[NH3]2[H2]3?[N2]=1.221.23?0.4=2.08?(mol?L-1)-2,故答案为:n3;?2.08(mol?L-1)-2;
(3)①50s内N2O3的浓度变化量为1.48mol?L-1,故NO2的浓度变化量为2.96mol?L-1,据v=△c△t=2.96mol/l50s=0.0592mol?L-1?s-1,故答案为:0.0592mol?L-1?s-1;?
②氢氧燃料电池中,氢气做负极,发生失电子成为氢离子的反应,在熔融盐Na2CO3的作用下,电极反应为:H2+CO32-═CO2+H2O+2e-,故答案为:H2+CO32-═CO2+H2O+2e-.
本题解析:
本题难度:一般