时间:2017-08-01 00:19:38
1、填空题 1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律,称为盖斯定律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,
C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,
则金刚石转化石墨时的热化学方程式为:_____________________。由此看来更稳定的碳的同素异形体为:____________。若取金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为_____________(用含Q的代数式表示)。
2、选择题 由金红石(TiO2)制取单质Ti,涉及到的部分步骤为:
TiO2→TiO4
3、填空题 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
已知:
①CO(g)+?1/2O2(g)=CO2(g)?△H=-283.0kJ/mol?
②S(s)+?O2(g)=SO2(g)?△H=-296.0kJ/mol?
此反应的热化学方程式是___________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知: ?
①?CO(g)+NO2(g)=NO(g)+CO2(g)?△H=-akJ/mol?(a>0) ?
②?2CO(g)+2NO(g)=N2(g)+2CO2(g)?△H=-bkJ/mol?(b>0)
若用标准状况下?3.36LCO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_______mol,放出的热量为________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如: ?
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H1=-574kJ/mol?① ?
②CH4(g)+4NO?(g)=2N2(g)+CO2(g)+2H2O(g)?△H2=?②
若1molCH4还原NO2至N2整个过程中放出的热量为867KJ,则△H2=_________。
4、选择题 一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
下列选项正确的是
[? ]
A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
B.反应CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)的焓变为△H3,△H3>△H1
C.若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子的物质的量为3.2 mol
5、选择题 在常温常压下,已知:4Fe(s) +3O2(g) =2Fe2O3(s) △H1
4Al(s) +3O2(g) = 2Al2O3(s) △H2
2Al(s) +Fe2O3(s)=Al2O3(s) +2Fe(s) △H3
则△H3与△H1和△H2间的关系正确的是
[? ]
A.
B.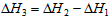
C.
D.