时间:2017-08-01 00:12:18
1、填空题 用下列:①H2O?②H2O2?③Ba(OH)2?④Na2O2?⑤Cl2?⑥Ar?⑦CO2?等物质填空。(填序号)
(1) 由离子键和非极性键构成的是 ?
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是?
(4) 共价化合物有
(5) 含有极性共价键的离子化合物的是?
参考答案:(7分)(1)④,(2)② ,(3)⑥ ,(4)①②⑦,⑸ ③
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键。含有离子键的化合物就是离子化合物,全部由共价键形成的化合物是共价化合物。 根据以上信息解答。
点评:本题主要考查了化学键的判断、化学键和化合物的关系,题目难度不大,考查学生对基础知识的掌握程度。
本题难度:简单
2、选择题 下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤对电子,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用
参考答案:B
本题解析:配位化合物中必定存在配位键,A正确;B不正确,在配位化合物中还含有其他化学键;C中水中的氧原子含有孤对电子,铜离子含有空轨道,可以形成配位健,C正确,D也水正确的,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对配位健以及配位化合物的了解掌握情况,有利于培养学生的学习兴趣,调动学生的学习兴趣,提高学生的学习效率和应试能力。
本题难度:一般
3、选择题 在298K时,2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是
2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是
A.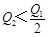
B.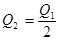
C.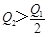
D.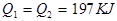
参考答案:A
本题解析:因为二氧化硫与氧气的反应是可能反应,所以反应物不会彻底转化,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,则Q1<197kJ;向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,若平衡不移动,则放出的热量是Q1的一半,而反应物浓度减少,则平衡逆向进行,所以放出的热量比Q1的一半还少,则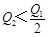 <98.5kJ,答案选A。
<98.5kJ,答案选A。
考点:考查反应物浓度对平衡的影响,可逆反应的理解
本题难度:一般
4、选择题 下列说法或表示方法正确的是
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石)ΔH = +1.9kJ/mol”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH =" -" 57.3kJ/mol,若将含1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表为:2H2(g)+O2(g)=2H2O(l)ΔH = —285.8kJ/mol
参考答案:C
本题解析:
试题解析:固体硫变为硫蒸汽要吸热,则燃烧时放出的热量较少,故A错误;反应为吸热反应,则石墨能量比金刚石小,能量越低越稳定,故B错误;醋酸为弱电解质,电离吸热,则放出的热量小于57.3kJ,故C正确;反应放热,应为△H=-285.8kJ/mol,故D错误.
考点:反应热和焓变
本题难度:一般
5、填空题 (16分)原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,盛?的试管中气体产生较快,盛?的试管中气球变得更大;
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3—(aq)+ H+(aq) ="===" H2O(l)+ CO2(g)? △H>0
CO32—(aq)+ 2H+(aq) ="===" H2O(l)+ CO2(g)? △H<0
甲下结论的方法是否正确?(填“正确”或“不正确”)
(3)为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合 前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
参考答案:(1)? NaHCO3? NaHCO3?(2)?不正确
(3)?吸热?放热?吸热?放热? a c
本题解析:(1)碳酸钠和盐酸是分步进行的,首先生成碳酸氢钠和氯化钠,然后碳酸氢钠和盐
酸生成CO2气体。所以碳酸氢钠产生气体的速度快。质量相等的条件下,碳酸氢钠生成的气体多。
(2)影响溶液温度变化的原因比较复杂,例如溶解过程也会伴随能量的变化,其次如果反应中的能量变化不明显,仅靠触摸是不准确的,而应该通过温度计测量温度的变化。
(3)实验1和2属于物质的溶解过程,根据温度的变化分析可判断,碳酸氢钠溶于水是吸热的,碳酸钠溶于水是放热的。根据温度的变化可知实验3是吸热的,实验4是放热的。根据以上分析可知NaHCO3固体与稀盐酸反应的反应热是溶解过程吸收的能量和反应过程中的吸收的能量的两部分之和,即是a和c的热效应之和。
本题难度:简单