时间:2017-07-27 11:01:46
1、实验题 (18分)某中学高一课外兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验。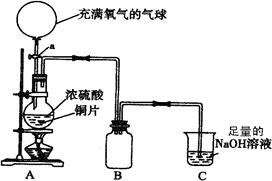
(1)先关闭活塞a,将6.4g铜片和12 mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:关闭活塞a?;
打开活塞a?;
②B是用来收集实验中产生的气体的装置,但导管未画全,请在上图中把导管补充完整;
③实验结束后,装置C中的溶液中可能含有的溶质有?。
(2)该小组甲同学对“如何检验SO2中混有少许CO2”这个问题很感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置: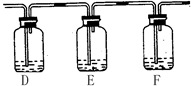
试剂:a. NaOH溶液? b. 品红溶液? c. 酸性KMnO4溶液? d. Ca(OH)2溶液
请回答:
①该同学的实验装置A中发生的化学方程式? ?。
?。
②若要达到此目的,可以在:(填所提供试剂编号)
D中加入?;E中加入?;F中加入?。
(3)事实证实,第(1)问铜片完全消失后,硫酸仍有剩余,乙同学欲测定余酸的物质的量浓度,假设反应前后溶液体积变化忽略不计,他向反应后溶液中加入含溶质a mol 的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:?mol/L(
的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:?mol/L( 用含a的代数式表达,若不能,该空不填)。
用含a的代数式表达,若不能,该空不填)。
参考答案:
(1)①Cu+2H2SO4(浓)  CuSO4+SO2?+2H2O;(2分)
CuSO4+SO2?+2H2O;(2分)
2Cu+O2+2H2SO4 2CuSO4+2H2O (2分
2CuSO4+2H2O (2分 )
)
(或分步写成:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O,也可)
②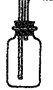 ? (2分)
? (2分)
③NaOH? Na2SO3? Na2SO4?(3分)
(2)①C+2H2SO4(浓)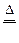 ?CO2?+2SO2?+2H2O?(3分)
?CO2?+2SO2?+2H2O?(3分)
②? c? b? d?(3分)
(3)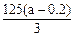 ?(3分,其余合理表达式均可)
?(3分,其余合理表达式均可)
本题解析:略
本题难度:简单
2、实验题 (10分)某研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验。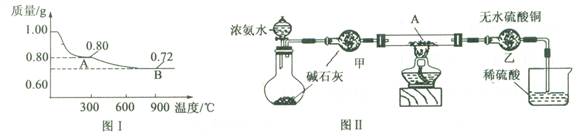
(1)取0.98 g Cu(OH)2固体加热,质量随温度变化的曲线如图1所示,产物A、B的化学式分别为?和?。
(2)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为?。
(3)为证明产物A在加热时能与NH3反应,某同学设计了如图Ⅱ(夹持装置未画出)所示实验装置。
①简述检查该装置气密性的方法?。
②实验过程中观察到两个明显现象: i直玻璃管中固体由黑色变为红色;ii装置乙中固体由白色变为蓝色。能证明产物A与NH3发生了反应的判断依据的是?(填选项字母)。
a.只有i可以? b.只有ii可以? c.i或ii都可以
参考答案:(1)CuO? Cu2O
(2)Cu2O + 2H+ = Cu2+ + Cu + H2O
(3)①如图连接装置,关闭分液漏斗旋塞,将末端导管浸入水中;用热毛巾捂住烧瓶底部,若导管口有气泡连续冒出,撤掉热毛巾,冷却至室温后导管内形成一段液柱且持续不落,则证明装置气密性良好。
②b
本题解析:(1)不溶于水解的碱Cu(OH)2可加热脱水:Cu(OH)2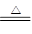 CuO+H2O,由反应前后两固体物质的质量比为98:80≈1.00:0.80可猜测出A物质为CuO
CuO+H2O,由反应前后两固体物质的质量比为98:80≈1.00:0.80可猜测出A物质为CuO
铜的氧化物有CuO及Cu2O,CuO加热质量继续减小,根据反应:4CuO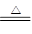 2Cu2O+O2↑可看出,反应前后两固体物质的质量比为80:72,符合题意,故可知B物质为Cu2O
2Cu2O+O2↑可看出,反应前后两固体物质的质量比为80:72,符合题意,故可知B物质为Cu2O
(2)Cu2O在酸性条件下生成了铜单质及硫酸铜,即岐化反应:Cu2O + 2H+ = Cu2+ + Cu + H2O
(3)①关闭分液漏斗旋塞,将末端导管浸入水中;用热毛巾捂住烧瓶底部,若导管口有气泡连续冒出,撤掉热毛巾,冷却至室温后导管内形成一段液柱且持续不落,则证明装置气密性良好。
②由题意知道,CuO加热可分解生成红色的Cu2O,故“直玻璃管中固体由黑色变为红色”,不能说明氨气与CuO参加了反应;
由于氨气经干燥管吸水后得到无水的氨气,而无水硫酸铜变蓝,说明有水生成,而其中的氢元素只能来自于氨气,故此现象可做为氨气参加反应的依据
b选项符合题意
本题难度:简单
3、填空题 现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复)。
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
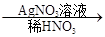 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题: 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。| 实验步骤 | 预期现象和结论 | ||||||||||||
| 取适量C的溶液于试管中,?①? ?。 | 预期现象和结论1:?②?; 预期现象和结论2:?③?; 参考答案:(14分)(1)A:H2SO4? B:Ba(OH)2? (2)Ag++Cl-=AgCl↓?(各2分,共6分) 本题解析:(1)0.1 mol/L A溶液的pH<1,这说明A应该是二元强酸,所以A是硫酸。将B溶液分别与其它四种溶液混合,均有白色沉淀生成,这说明B中含有OH-和Ba2+,即B是氢氧化钡,且一定不存在硝酸铵或氯化铵。 本题难度:一般 4、实验题
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。 试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。 参考答案:(1)② Cu + 2H2SO4(浓) 本题解析:(注:本题下载后无题文部分) 本题难度:一般 5、实验题 (5分)某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据: 。 参考答案:(5分) 本题解析:由于金属钙为特别活泼的金属,故在制取Ca3N2的过程中,必须保证系统中无其它杂质气体,保证气密性良好:实验前先通入氮气,再加热,实验结束时,先停止加热、冷却后再停止通氮气 本题难度:一般 |