时间:2017-07-27 10:56:41
1、选择题 预测H2S和BF3的立体结构,两个结论都正确的是( ? )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
参考答案:D
本题解析:H2S的中心原子含有2对孤电子对数,所以是V形结构。BF3的中心原子没有孤对电子,所以是平面三角形结构,因此答案选D。
本题难度:一般
2、选择题 下列说法正确的是( )
A.离子化合物中阴阳离子间只有静电引力
B.在共价化合物中不可能含有离子键
C.含有共价键的化合物一定是共价化合物
D.含有离子键的化合物不一定是离子化合物
参考答案:A、因离子键是阴阳离子间的静电作用形成的,则在离子化合物中阴阳离子间有静电引力和斥力,故A错误;
B、因含离子键的化合物一定为离子化合物,则共价化合物中一定不含有离子键,故B正确;
C、含有共价键的化合物中也可能含有离子键,如NaOH,故C错误;
D、含有离子键的化合物一定是离子化合物,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=-Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是 ( )
A.Q1>Q2>Q3
B.Q1>Q3>Q2
C.Q3>Q2>Q1
D.Q2>Q1>Q3
参考答案:A
本题解析:已知①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-Q1 kJ/mol,
②2H2S(g)+O2(g)="2S" (s)+2H2O(l)△H=-Q2 kJ/mol,
③2H2S(g)+O2(g)="2S" (s)+2H2O(g)△H=-Q3kJ/mol,
①与②相比较,由于S→SO2放热,则Q1>Q2,②与③相比较,由于H2O(l)→H2O(g)吸热,则Q2>Q3,
则Q1>Q2>Q3,选A.
考点:考查反应热的大小比较。
本题难度:一般
4、简答题 (18分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子的空间构型为___________;水分子自身作用会生成阴、阳两种离子,其中阴离子的电子式是___________ ?
?
(2)如图是某品牌饮用矿泉水标签的部分内容。请计算一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________。
(3)标况下将a L氨气溶于1L水中,得到的溶液密度为b g·cm﹣3。用化学方程式表示氨气溶于水显碱性的原因___________该溶液的物质的量浓度为___________mol·L﹣1。
(4)已知M是生活中常见的一种金属,将44.8 g M完全溶于很稀的过量硝酸,向所得溶液中加入足量固体烧碱并加热,放出6.72 L(标准状况)气体。M溶于该很稀的硝酸的离子方程式为___________________。M与水在高温条件下,生成1g气体吸热a kJ,写出该反应的热化学方程式_________________________________。
(5)味精是常用的调味品,当前味精生产主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
①淀粉发生水解反应的化学方程式是_________________________________
②实验室中检验淀粉水解产物应选用的试剂可以是___________ (填字母)·
A.NaOH溶液、氨水、AgNO3溶液
B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液
D.H2SO4溶液、CuSO4溶液
参考答案:(1)角型(或V型、折型)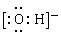 ;(2)1×10-4mol;
;(2)1×10-4mol;
(3)NH3+H2O NH3.H2O
NH3.H2O NH4++OH-;
NH4++OH-;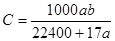 mol/L
mol/L
(4)8Fe+30H++3NO3-=8Fe3++3NH4++9H2O,3Fe(s)+4H2O(g)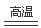 Fe3O4(s)+4H2(g)?H=+8aKJ/mol
Fe3O4(s)+4H2(g)?H=+8aKJ/mol
(5)①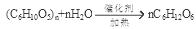 ?②A、C
?②A、C
本题解析:(1)在水分子中两个H—O键之间的键角为104.3°,所以水分子的空间构型为角型(或V型、折型);水分子自身作用会生成阴、阳两种离子,电离方程式为H2O H++OH-。其中阴离子OH-的电子式是
H++OH-。其中阴离子OH-的电子式是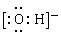 ;(2)SO42-的物质的量为:19.2×10-3g/L÷96g/mol=2×10-4mol/L。这瓶矿泉水的体积是0.5L,因此其含有的SO42-的物质的量的最大值为2×10-4mol×0.5L=1×10-4mol;(3) 氨气溶于水显碱性的原因用方程式表示为:NH3+H2O
;(2)SO42-的物质的量为:19.2×10-3g/L÷96g/mol=2×10-4mol/L。这瓶矿泉水的体积是0.5L,因此其含有的SO42-的物质的量的最大值为2×10-4mol×0.5L=1×10-4mol;(3) 氨气溶于水显碱性的原因用方程式表示为:NH3+H2O NH3.H2O
NH3.H2O NH4++OH-;该溶液的质量分数是(a L÷22.4L/mol×17g/mol)÷(a L÷22.4L/mol×17g/mol+1000g)×100%=17a÷(17a+22400);因此该溶液物质的量浓度为
NH4++OH-;该溶液的质量分数是(a L÷22.4L/mol×17g/mol)÷(a L÷22.4L/mol×17g/mol+1000g)×100%=17a÷(17a+22400);因此该溶液物质的量浓度为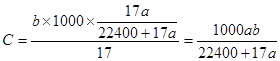 ?mol/L。(4)n(NH3)=6.72L÷22.4L/mol=0.3mol;每1mol的N由反应前的HNO3的+5价变为反应后的-3价,降低8价,所以产生0.3mol氨气转移电子的物质的量为8×0.3mol=2.4mol.在生活中常见的金属是Al、Fe,它们都是+3价的金属,假设金属的相对原子质量为M,则M÷44.8=3÷2.4,解得M=56.因此该金属是Fe.由于硝酸过量,所以M溶于该很稀的硝酸的离子方程式为8Fe+30H++3NO3-=8Fe3++3NH4++9H2O;根据题意可得Fe与水蒸气反应的热化学方程式为3Fe(s)+4H2O(g)
?mol/L。(4)n(NH3)=6.72L÷22.4L/mol=0.3mol;每1mol的N由反应前的HNO3的+5价变为反应后的-3价,降低8价,所以产生0.3mol氨气转移电子的物质的量为8×0.3mol=2.4mol.在生活中常见的金属是Al、Fe,它们都是+3价的金属,假设金属的相对原子质量为M,则M÷44.8=3÷2.4,解得M=56.因此该金属是Fe.由于硝酸过量,所以M溶于该很稀的硝酸的离子方程式为8Fe+30H++3NO3-=8Fe3++3NH4++9H2O;根据题意可得Fe与水蒸气反应的热化学方程式为3Fe(s)+4H2O(g)  Fe3O4(s)+4H2(g)?H=+8aKJ/mol;(5)①淀粉发生水解反应的化学方程式是
Fe3O4(s)+4H2(g)?H=+8aKJ/mol;(5)①淀粉发生水解反应的化学方程式是 ;②淀粉水解要在硫酸催化下反应,所以首先应该加入NaOH溶液中和硫酸,然后以氨水、AgNO3溶液为原料制取银氨溶液,向银氨溶液中加入淀粉飞水解产物,水浴加热,若产生银镜,就证明水解产生了葡萄糖;或先用NaOH溶液中和催化剂硫酸,再用NaOH溶液、CuSO4溶液制成新制Cu(OH)2悬浊液,把淀粉的水解溶液加入到新制Cu(OH)2悬浊液,加热煮沸,若产生砖红色沉淀,就证明淀粉水解得到了葡萄糖。因此选项为A、C。
;②淀粉水解要在硫酸催化下反应,所以首先应该加入NaOH溶液中和硫酸,然后以氨水、AgNO3溶液为原料制取银氨溶液,向银氨溶液中加入淀粉飞水解产物,水浴加热,若产生银镜,就证明水解产生了葡萄糖;或先用NaOH溶液中和催化剂硫酸,再用NaOH溶液、CuSO4溶液制成新制Cu(OH)2悬浊液,把淀粉的水解溶液加入到新制Cu(OH)2悬浊液,加热煮沸,若产生砖红色沉淀,就证明淀粉水解得到了葡萄糖。因此选项为A、C。
本题难度:一般
5、填空题 下列六种物质的变化中,将合适序号填写在下列空白中:
①干冰的升华;?②硫酸钾熔化;?③NaCl溶于水;?④HCl溶于水;?⑤液氨的受热蒸发;?⑥Na2O2溶于水
(1)仅需要克服分子间作用力的是______
(2)发生离子键破坏,又发生共价键破坏的是______
(3)发生共价键破坏的是______
(4)发生离子键破坏的是______.
参考答案:①干冰属于分子晶体,融化时克服分子间作用力;
②硫酸钾属于离子晶体,融化时破坏离子键;
③氯化钠属于离子晶体,溶于水破坏离子键;
④HCl属于分子晶体,但溶于水时发生电离,破坏共价键;
⑤氨气属于分子晶体,受热蒸发是克服的是分子间作用力;
⑥为离子晶体,含有离子键和共价键,与水反应发生化学变化,离子键和共价键都发生变化.
故答案为:(1)①⑤;(2)⑥;(3)④;(4)②③.
本题解析:
本题难度:一般