时间:2017-07-27 10:33:15
1、选择题 用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 (? )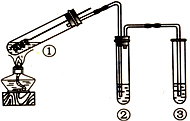
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
参考答案:(1)② Cu + 2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O KMnO4溶液
CuSO4 + SO2↑+ 2H2O KMnO4溶液
③A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2)②2H2S + SO2 =" 3S↓" + 2H2O
③
?
BaSO4
BaSO3
?
Ba2+ + SO2 + Cl2 + 2H2O ="=" BaSO4↓+ 4H+ + 2Cl—
④0.56g 224mL ≤ V ≤ 448mL
本题解析:(注:本题下载后无题文部分)
(1)② Cu + 2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O KMnO4溶液
CuSO4 + SO2↑+ 2H2O KMnO4溶液
③A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2)②2H2S + SO2 =" 3S↓" + 2H2O
③
?
BaSO4
BaSO3
?
Ba2+ + SO2 + Cl2 + 2H2O ="=" BaSO4↓+ 4H+ + 2Cl—
④0.56g 224mL ≤ V ≤ 448mL
CO2通入KOH和Ca(OH)2的混合溶液中,第一步反应为
Ca(OH)2+CO2 CaCO3↓+H2O,Ca(OH)2恰好反应完时沉淀质量最大,此时可由0.01 mol CO2来算Ca(OH)2和CaCO3的物质的量为0.01 mol。第二步反应为KOH+CO2
CaCO3↓+H2O,Ca(OH)2恰好反应完时沉淀质量最大,此时可由0.01 mol CO2来算Ca(OH)2和CaCO3的物质的量为0.01 mol。第二步反应为KOH+CO2 KHCO3,KOH的质量为(1.3-0.01×74)g="0.56" g,所以n(KOH)="0.01" mol,第二步消耗的CO2也为0.01 mol ,第三步CaCO3+CO2+H2O
KHCO3,KOH的质量为(1.3-0.01×74)g="0.56" g,所以n(KOH)="0.01" mol,第二步消耗的CO2也为0.01 mol ,第三步CaCO3+CO2+H2O Ca(HCO3)2,又消耗0.01 mol CO2。最后一问上面第二步反应沉淀最大且质量不变,消耗CO2的值为0.01mol―0.02mol之间,体积为224mL ≤ V ≤ 448mL。
Ca(HCO3)2,又消耗0.01 mol CO2。最后一问上面第二步反应沉淀最大且质量不变,消耗CO2的值为0.01mol―0.02mol之间,体积为224mL ≤ V ≤ 448mL。
本题难度:一般
3、实验题 (16分)某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。(相对原子质量Fe:56)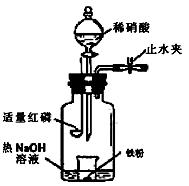
a.向广口瓶内注入足量热NaOH溶液,将盛有a g纯铁粉的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入200mL 6mol/L的稀硝酸,铁粉恰好完全溶解。
(一)气体产物成分探究
①实验前如何检查该装置的气密性?。
②燃烧红磷的目的是?。
③为证明气体产物为NO,步骤c后还缺少的一步主要操作是___________________。
(二)产物中铁元素价态探究:
(1)提出合理假设:
假设1:产物只有+3价铁;
假设2:?;
假设3:?。
(2)设计实验:分别取小烧杯中反应后溶液装入两支试管甲、乙,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象。推测实验现象与结论:
①若现象为:?,则假设1正确;
②若现象为:?,则假设2正确;
③若现象为:?,则假设3正确。
(3)a值范围为?。
参考答案:(一)①略。(2分)
②除去广口瓶内的氧气,避免干扰气体检验(2分)
③打开止水夹,向瓶内通入少量氧气;(2分)
(二)(1)假设2:产物中只有+2价铁元素(1分)。假设3:产物中既含+2价又有+3价铁元素(1分)。
(2)①甲试管溶液无明显变化,乙试管溶液变红色;(2分)
②甲试管溶液紫色褪去,乙试管没有明显变化;(2分)
③甲试管溶液紫色褪去,乙试管溶液变红色。(2分)
(3)16.8≤a≤25.2 (2分)
本题解析:略
本题难度:一般
4、实验题 (8分)碘在科研与生活中有重要的应用。某兴趣小组用0.50mol·L-1KI 、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1?Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知S2O82—+2I—=2SO42—+I2?(慢)? I2 +2S2O32—=2I—+S4O62—(快)
(1)向KI 、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中?(写离子符号)耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为n(S2O32—)︰n(S2O82—)?。?
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 | 体积/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | VX | 4.0 | 4.0 | 2.0 |
参考答案:(每空各2分)(1)S2O32—、?<2?
(2)2.0 、?保持溶液总体积不变,仅改变S2O82—的浓度而其他物质的浓度不变
本题解析:(1)溶液颜色将由无色变为蓝色,说明溶液中有单质碘生成。所以根据反应S2O82—+2I—=2SO42—+I2?(慢)和I2 +2S2O32—=2I—+S4O62—(快)可知,此时S2O32—已经消耗完毕。根据方程式可知,恰好反应时n(S2O32—)︰n(S2O82—)=2︰1,所以要能观察到蓝色,则n(S2O32—)要不足,即n(S2O32—)︰n(S2O82—)<2︰1。
(2)要探究浓度对反应速率的影响,则溶液的体积必须相同。根据①②可知,溶液的体积都是20ml,唯一不同的是S2O82—的物质的量,所以VX=2.0ml。
本题难度:一般
5、实验题 (15分)某实验小组同学对电化学原理进行了一系列探究活动。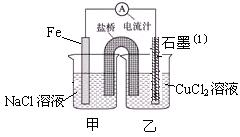
(1)右图为某实验小组依据氧化还原反应:(用离子方程式表示)?设计的原电池装置,一段时间后,两电极质量相差12g,导线中通过?mol电子。
(2)其它条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为?,这是由于NH4Cl溶液显?性,(填酸性、碱性或中性)用离子方程式表示溶液显此性的原因?,用吸管吸出铁片附近溶液少许至于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式?,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式?。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是?,电极反应为?;乙装置中石墨(1)为??极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为?,产物常用?检验,反应的离子方程式为?。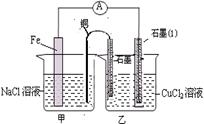
参考答案:
(1)Fe +Cu2+ ="==" Fe2+ + Cu?(1分)? 0.2mol。(1分)
(2)2H+ + 2e-="==" H2↑;酸(各1分)? NH4+ + H2O  ?NH3·H2O + H+(1分)
?NH3·H2O + H+(1分)
2Fe2+ + Cl2="==" 2Fe3+ + 2Cl-?(1分)?2Fe3++3Cl2+8H2O==2FeO42-?+6Cl-?(2分)
(3)溶液变红(1分)? O2+2H2O+4e—="==" 4OH—(2分)?阴(1分),2Cl——2e—===Cl2↑(1分),
湿润淀粉碘化钾试纸(1分),?Cl2?+ 2I- ="=" 2Cl— ?+I2 (1分)?。
本题解析:略
本题难度:简单