时间:2017-07-27 10:33:15
1、选择题 下列气体既不能用浓H2SO4干燥又不能用碱石灰干燥的是(?)
A.Cl2
B.HI
C.NH3
D.CO2
2、填空题 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象;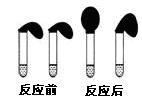
乙:① 用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/25 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH?1(填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:?
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)?
B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4?D.2 mol·L-1 HA
(3)pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有 ? ?
?
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸?
E.稀释后A溶液中水的电离程度比B溶液中水的电离程度小
3、填空题 (15分)
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |

4、选择题 右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是(?)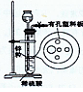
①食盐水?②KNO3溶液?③适量稀硫酸铜溶液
④Na2CO3溶液?⑤CCl4?⑥浓氨水
A.①③⑤
B.①②③
C.④⑤⑥
D.①②③⑤
5、实验题 (9分)为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实验装置。实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空: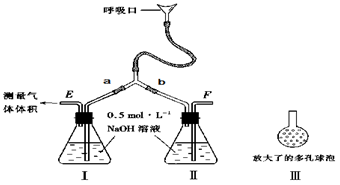
⑴图中瓶II的作用是______________________________。
⑵对实验装置尚有如下A、B、C、D四种观点,你认为合理的是________。(填代号)
A.在E处增加CaCl2干燥管 ? B.在F处增加CaCl2燥管
C.在E和F两处增加CaCl2干燥管 D.不必增加干燥管
⑶将插入溶液的管子末端改成具有多孔的球泡(图中的III),有利于提高实验的准确度,?
其理由是__________________________________________。
⑷实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重ag,收集到的气
体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式)?___________。
⑸为防止实验中若猛吸猛呼,会造成不安全后果,将实验装置如何改进?。