时间:2017-07-27 10:33:15
1、实验题 某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质。
⑴提出问题:溴水能否与氯化亚铁溶液反应
⑵猜想:
①甲同学认为:不能,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含? (填化学式,下同)所致
②:能,故上述实验现象是发生化学反应所致,则溶液呈黄色是含? 所致。
⑶设计实验并验证丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。除氯化亚铁溶液和溴水外,还有供选用的试剂:a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
⑷结论:溴水能与氯化亚铁溶液反应。故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为?
⑸实验后的思考该兴趣小组在查阅资料同时得知:在溴化亚铁溶液中通入Cl2,Cl2先将Fe2+完全氧化成Fe3+后,再与 Br-反应。根据上述信息,试回答:在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为?
参考答案:(2)①Br2②Fe3+
(3)b;CCl4层呈无色
d;溶液变成红色
(4)2Fe2++Br2==2Fe3++2Br-
(5)1mol/l
本题解析:
本题难度:困难
2、选择题 每个梦想都值得灌溉,每个人骨子里都不缺少勇气,成功没有任何隐藏的奥秘,只有自己。谢谢《功夫熊猫》中的熊猫阿宝,让我们收获了梦想、勇气与责任。今天,让我们充满期待开始我们的高中化学学习之旅。以下是一些人对化学的认识,你认为不正确的是
[? ]
A.化学面对日益严重的环境问题显得无能为力,学不学无关大局
B.化学是一门以实验为基础的自然科学,可以培养我们的动手能力
C.化学是一门具有极强实用性的科学,应该予以重视
D.化学将在能源、资源的合理开发和安全应用方面大显身手
参考答案:A
本题解析:
本题难度:简单
3、实验题 (8分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。请你协助他们探究所得气体的成分。
【提出猜想】
猜想一:所得气体中可能是SO2。
猜想二:所得气体中可能是??。
猜想三:所得气体中可能是??的混合气体。
【实验探究】
(1)将所得气体通入如下装置
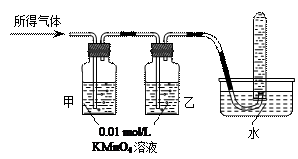 |
参考答案:(8分)猜想二:所得气体中可能是H2(1分)
猜想三:所得气体中可能是SO2和H2的混合气体(2分)
(1)甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体(3分)
(2)验纯(2分)
本题解析:略
本题难度:一般
4、选择题 查阅资料发现,金属钠不仅能与氧气和水反应,还能与很多种其他物质发生反应,其中包括与酒精在常温下反应,要研究金属钠和酒精、金属钠和水反应的异同点,下列的研究方法中用不到的是(?)
A.观察法
B.分类法
C.实验法
D.比较法
参考答案:B
本题解析:研究金属钠和酒精、金属钠和水反应的异同点,可以采用的研究方法有观察法,即观察两者发生反应的剧烈情况; 实验法和比较法,即通过实验比较两者反应的剧烈情况,分类法对研究金属钠和酒精、金属钠和水反应的异同点没有意义,故本题的答案选择B。
点评:本题考查了化学探究过程中所采用的研究方法,所以对学生科研基本功的考查,该题比较简单。
本题难度:简单
5、实验题 (14分)黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS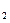 )进行如下实验探究。
)进行如下实验探究。
[实验一]:测定硫元素的含量
I.将m g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为: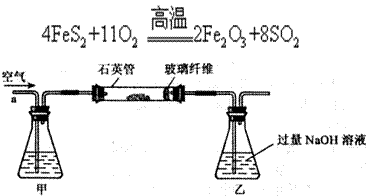
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: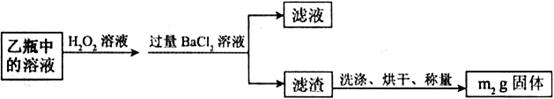
问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有________________________、________________________________。
(2)Ⅱ中。所加H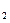 O
O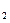 溶液需足量的理由是________________。
溶液需足量的理由是________________。
(3)该黄铁矿石中硫元素的质量分数为________________。
[实验二]:设计以下实验方案测定铁元素的含量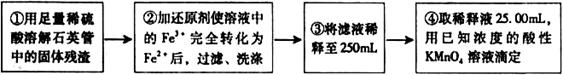
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?________。若不合理,会如何影响测量结果:________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(6)④中高锰酸钾溶液应放在_____滴定管中;判断滴定终点的现象为________________。
参考答案:(14分)
(1)氢氧化钠(或氢氧化钾等)(2分)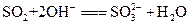 ?(2分)?
?(2分)?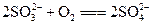 (2分)
(2分)
(2)使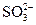 完全氧化为
完全氧化为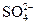 ?(1分)?
?(1分)?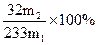 (或其他合理答案)?(2分)
(或其他合理答案)?(2分)
(4)不合理,?会使所测得的铁元素的质量分数偏大(2分)
(5)250mL容量瓶(1分)
(6)酸式、溶液恰好变为紫色,且半分钟不退去。(2分)
本题解析:略
本题难度:一般