时间:2017-07-27 10:13:32
1、填空题 能说明醋酸是弱电解质的是
A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液
B.用食醋可以除热水瓶内的水垢
C.pH=2的醋酸溶液稀释1000倍后pH小于5
D.用浓H2SO4和醋酸钠固体共热可制得醋酸
参考答案:C
本题解析:略
本题难度:一般
2、选择题 常温下,0.1 mol/L某一元酸(HA)溶液中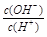 =1×10-8,下列叙述正确的是(? )
=1×10-8,下列叙述正确的是(? )
A.溶液中水电离出的c(H+)=10-10 mol/L?
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
参考答案:C
本题解析:0.1 mol/L某一元酸(HA)溶液中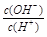 =1×10-8,而溶液中c(H+)·c(OH-)=10-14.解得c(OH-)=10-11.所以c(H+)10-3mol/L<c(HA),所以该酸是弱酸。A.所以溶液中水电离出的c(H+)=c(OH-)=10-11 mol/L。错误。B.根据物料守恒可得c(HA)+c(A-)=0.1 mol/L。错误。C.在弱酸的溶液中存在电离平衡HA
=1×10-8,而溶液中c(H+)·c(OH-)=10-14.解得c(OH-)=10-11.所以c(H+)10-3mol/L<c(HA),所以该酸是弱酸。A.所以溶液中水电离出的c(H+)=c(OH-)=10-11 mol/L。错误。B.根据物料守恒可得c(HA)+c(A-)=0.1 mol/L。错误。C.在弱酸的溶液中存在电离平衡HA A-+H+。溶液中加入一定量CH3COONa晶体,由于会发生反应CH3COO-+ H+=CH3COOH,会使c(H+)减小,所以根据水的离子积常数不变可知溶液的c(OH-)增大;若加水稀释,由于离子浓度减小的倍数多,所以平衡向电离的方向移动。由于稀释的倍数大于平衡移动增大的倍数。所以c(H+)减小。正确。D.若与0.05mol/LNaOH溶液等体积混合后,则得到的溶液为NaA与HA等浓度、等体积的混合溶液。由于酸的电离大于盐的水解,所以c(A-)>c(Na+)>c(H+)>c(OH-)。错误。
A-+H+。溶液中加入一定量CH3COONa晶体,由于会发生反应CH3COO-+ H+=CH3COOH,会使c(H+)减小,所以根据水的离子积常数不变可知溶液的c(OH-)增大;若加水稀释,由于离子浓度减小的倍数多,所以平衡向电离的方向移动。由于稀释的倍数大于平衡移动增大的倍数。所以c(H+)减小。正确。D.若与0.05mol/LNaOH溶液等体积混合后,则得到的溶液为NaA与HA等浓度、等体积的混合溶液。由于酸的电离大于盐的水解,所以c(A-)>c(Na+)>c(H+)>c(OH-)。错误。
本题难度:一般
3、选择题 对某弱酸稀溶液加热时,下列叙述错误的是(?)
A.弱酸的电离程度增大
B.弱酸分子的浓度减小
C.溶液的c(OH-)增大
D.溶液的导电性增强
参考答案:C
本题解析:电离一般为吸热反应,升高温度,平衡向正反应方向移动。
本题难度:简单
4、选择题 pH相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH同,则X、Y、Z的关系是( )
A.X=Y=Z
B.X>Y=Z
C.X<Y=Z
D.X=Y<Z
参考答案:氨水是弱电解质,氢氧化钠和氢氧化钡是强电解质,加水稀释过程中,促进氨水电离,导致氨水中n(OH-)增大,而氢氧化钠和氢氧化钡中n(OH-)不变,要使稀释后三种溶液的pH同,则溶液体积关系为:氨水>氢氧化钠=氢氧化钡,所以
X、Y、Z的关系是X>Y=Z,故选B.
本题解析:
本题难度:一般
5、填空题 已知HA是一种弱酸。请回答下列问题:
(1)现有一种含有HA和其钠盐NaA的溶液。
①组成该溶液的微观粒子有 ;
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是 ;
③若向该溶液中逐滴加入NaOH溶液时,下列图像能表示 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。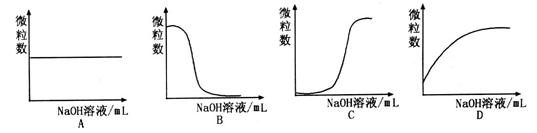
(2)现将1体积0.04mol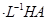 溶液和1体积0.02mol
溶液和1体积0.02mol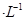 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。
①若该混合液显碱性,则其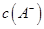 0.01 mol
0.01 mol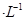 (填“<”、“=”或“>”);
(填“<”、“=”或“>”);
②若该混合液显酸性,则溶液中所有离子的浓度由大到小的顺序是 。
参考答案:(1)①H2O、HA、H+、Na+、OH?、A-(2分,有错不得分)
②A-+H+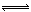 HA(2分,不写可逆号也可)
HA(2分,不写可逆号也可)
③D(1分)
(2)①<(1分)
②c(A-)>c(Na+)>c(H+)>c(OH?)(2分)
本题解析:(1)①溶液中的微观粒子既包括离子,也包括分子,所以含有HA和其钠盐NaA的溶液的微观粒子有:H2O、HA、H+、Na+、OH?、A-
②加入少量盐酸,HCl与NaA反应生成HA,所以离子方程式为:A-+H+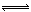 HA
HA
③溶液含有HA和NaA,逐滴加入NaOH溶液,HA与NaOH反应生成NaA和H2O,所以A2-数目逐渐增大,故D项正确。
(2)①1体积0.04mol/LHA溶液和1体积0.02mol/LNaOH溶液混合,HA过量,得到等量的NaA和HA,若该混合液显碱性,则c(H+)<c(OH?),根据电荷守恒c(H+)+c(Na+)=c(OH?)+c(A-)可得c(A-)<0.01mol?L?1。
②若该混合液显酸性,则HA的电离程度大于NaA的水解程度,溶液中所有离子的浓度由大到小的顺序是:c(A-)>c(Na+)>c(H+)>c(OH?)
考点:本题考查盐类的水解、弱电解质的电离、离子浓度比较。
本题难度:困难