时间:2017-07-27 10:13:32
1、选择题 下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO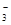 、AlO
、AlO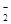 、K+、S2-等离子
、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
2、选择题 已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是(?)
A.25℃时,0.1 mol·L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生
D.加入CaCl2溶液后体系中的c(H+)浓度不变
3、选择题 现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列正确的是( )
A.①④②③⑥⑤
B.④①②⑥⑤③
C.①④②⑥③⑤
D.④①②③⑥⑤
4、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中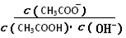 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH <7
5、简答题 ①常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,比较两溶液的pH,盐酸______(填“<”、“=”或“>”)醋酸,写出醋酸电离的方程式______.
②测得某溶液的pH=6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈______性.测定温度______室温(填高于、低于或等于),其理由是______.