时间:2017-07-27 10:09:31
1、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| D | C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
参考答案:B
本题解析:A、某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该钾盐可能含CO32-、HCO3-,故A错误;B、向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,Fe3+发生水解反应:Fe3++3H2O?Fe(OH)3+3H+,足量Mg(OH)2消耗H+促进Fe3+水解,使Fe3+完全水解成Fe(OH)3过滤除去,故B正确;C、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓CO32-转化BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故C错误;D、C2H5OH与制得的乙烯都有还原性,通入酸性KMnO4溶液都会褪色,故D错误。
考点:本题考查实验方案的设计与分析。
本题难度:一般
2、选择题 实验:
①0.1mol?L-1AgNO3溶液和0.1mol?L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1mol?L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1mol?L-1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
参考答案:A.根据浊液a中含有AgCl,存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),故A正确;
B.滤液为AgCl的饱和溶液,也存在沉淀的溶解平衡,即存在Ag+,故B错误;
C.向AgCl中滴加0.1mol?L-1KI溶液,白色AgCl沉淀变为黄色AgI沉淀,故C正确;
D.向AgCl中滴加0.1mol?L-1KI溶液,白色AgCl沉淀变为黄色AgI沉淀,实验证明AgI比AgCl更难溶,故D正确;
故选:B.
本题解析:
本题难度:简单
3、选择题 氯化银在水中存在溶解平衡:AgCl?Ag++Cl-.在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是( )
A.0.1mol/L?HCl
B.蒸馏水
C.0.1mol/LAlCl3
D.0.1mol/LMgCl2
参考答案:将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小,则Cl-浓度应最大,题中C项Cl-浓度最大,
故选C.
本题解析:
本题难度:简单
4、选择题 25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为
A.1.8×10-7mol/L
B.1.8×10-8 mol/L
C.1.8×10-9mol/L
D.1.8×10-10mol/L
参考答案:A
本题解析:50 ml 0.02mol/L的盐酸中加入50ml 0.018mol/L AgNO3溶液加入后两者浓度分别变为c(Ag+)=0.018mol/L÷2=0.009 (mol/L)、c(Cl-)=0.02mol/L÷2=0.01(mol/L),因此反应后Cl-过量,过量的氯离子浓度=0.01mol/L-0.009mol/L=0.001mol/Lmol/L,因此根据溶度积常数 Ksp=c(Ag+)×C(Cl-)=1.8×10-10可知,溶液中c(Ag+)=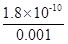 =1.8×10-7mol/L,答案选A。
=1.8×10-7mol/L,答案选A。
考点:考查溶度积常数的应用
本题难度:一般
5、填空题 有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀.试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 甲 B 乙 D |

参考答案:(1)B(氢氧化钡溶液)+D(明矾溶液) 自始至终都有白色沉淀(BaSO4);B(氢氧化钡溶液)+C(硫酸铝溶液) 自始至终都有白色沉淀(BaSO4);B(氢氧化钡溶液)+E(混有少量硝酸的硫酸镁溶液) 自始至终都有白色沉淀(BaSO4);这三组中的甲、乙两种物质互相交换,又得到3种组合,共有6种组合,另A(氢氧化钠溶液)+E(混有少量硝酸的硫酸镁溶液),将A加入到E中开始没有白色沉淀生成,则有:
组别12345678甲BCBEED乙CBEBAB故答案为:组别12345678甲BCBEED乙CBEBAB(2)将氢氧化钡溶液逐滴加入明矾溶液中,当 n[Ba(OH)2]n[KAl(SO4)2]=32时,产生沉淀的物质的量最大,此时反应式为:
3Ba(OH)2+2KAl(SO4)2=3BaSO4↓+2Al(OH)3↓+K2SO4;当 n[Ba(OH)2]n[KAl(SO4)2]=2时,产生沉淀的物质的量最小,反应为:
2Ba(OH)2+KAl(SO4)2=2BaSO4↓+KAlO2+2H2O;产生1 mol Al(OH)3沉淀时需消耗3 mol OH-,溶解1 mol Al(OH)3沉淀时需消耗1 mol OH-,据此作出图象如下: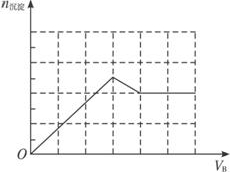
,故答案为:
;
(3)甲为Ba(OH)2,乙为HNO3和MgSO4的混合溶液时,符合给出的图示关系,原理:将Ba(OH)2溶液逐滴加入HNO3和MgSO4的混合溶液中,开始加入的Ba(OH)2将HNO3中和,产生的沉淀只有BaSO4;等到将HNO3完全被中和后再继续滴加Ba(OH)2溶液,在产生BaSO4沉淀的同时还会产生Mg(OH)2沉淀,图象中线的斜率增大(陡度增大);等到溶液中的 完全沉淀后,再继续滴加Ba(OH)2溶液,只产生Mg(OH)2沉淀,此时图象中直线的斜率变小,当溶液中的Mg2+完全沉淀后,产生的沉淀量保持不变(图象保持水平).
故答案为:Ba(OH)2;HNO3和MgSO4
本题解析:
本题难度:一般