时间:2017-07-27 09:44:12
1、填空题 (1)对于Ag2S(s) 2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(2)下列说法不正确的是__________。
A. 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
B. 物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
C. 对于Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
D. 除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
E. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
参考答案:(1)[c(Ag+)]2·c(S2-)
(2)BD
本题解析:
本题难度:一般
2、选择题 已知AgCl能溶于氨水而生成[Ag(NH3)2]+.NH4Cl溶液和AgNO3溶液混合后,再滴入NaOH溶液,溶液中沉淀量y与NaOH溶液加入量x的关系曲线不可能是( )
A.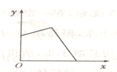
B.
C.
D.
参考答案:分析时应注意考虑到NH4Cl溶液和AgNO3溶液混合后,二者是否能恰好反应完,若不能,AgNO3是否过量,因为Ag+在碱性条件下可生成AgOH沉淀.
A、若AgNO3过量,加入NaOH后,开始时沉淀量增加,后来因有一部分AgCl沉淀转化为[Ag(NH3)2]+而减少,因NH4+的量不足,故沉淀不可能全部转化为[Ag(NH3)2]+,故A错误;
B、若AgNO3过量,加入NaOH后,开始时沉淀量增加,后来因有一部分AgCl沉淀转化为[Ag(NH3)2]+而减少,因NH4+的量不足,故沉淀不可能全部转化为[Ag(NH3)2]+,故B正确;
C、若混合前n(NH4Cl)≥2n(AgNO3),加入足量NaOH后沉淀全部溶解,故C正确;
D、若2n(AgNO3)>n(NH4Cl)>n(AgNO3),加入一定量NaOH溶液,沉淀部分溶解,故D正确;
故选A.
本题解析:
本题难度:简单
3、选择题 在一饱和AgCl水溶液(含有AgCl固体)中,添加下列试剂能使c(Cl-)增加的是(?)
A.氨水
B.硝酸
C.水
D.AgNO3
参考答案:A
本题解析:根据沉淀溶解平衡可知:AgCl(s) Ag+(aq)+Cl-(aq),加入氨水可以将Ag+转变成Ag(NH3)2+使平衡正向移动,c(Cl-)增加,加入硝酸不影响c(Ag+)和c(Cl-)浓度,平衡不移动,加水,饱和溶液仍为饱和溶液,c(Ag+)和c(Cl-)浓度不变,加AgNO3,c(Ag+)增加c(Cl-)减少。答案选A。
Ag+(aq)+Cl-(aq),加入氨水可以将Ag+转变成Ag(NH3)2+使平衡正向移动,c(Cl-)增加,加入硝酸不影响c(Ag+)和c(Cl-)浓度,平衡不移动,加水,饱和溶液仍为饱和溶液,c(Ag+)和c(Cl-)浓度不变,加AgNO3,c(Ag+)增加c(Cl-)减少。答案选A。
点评:改变影响平衡移动的一个因素,平衡总是向减弱这种改变的方向移动。
本题难度:一般
4、选择题 一定温度时,向饱和的BaSO4溶液中加水,下列叙述正确的是
A.BaSO4溶解度增大,Ksp不变
B.BaSO4溶解度、Ksp均增大
C.BaSO4溶解度不变,Ksp增大
D.BaSO4溶解度、Ksp均不变
参考答案:D
本题解析:一定温度时,向饱和的BaSO4溶液中加水BaSO4溶解度不变,Ksp也不变,因此选项是D。
考点:考查难溶性物质的饱和溶液中加水的过程中的物质的溶解度、溶度积常数的变化关系的知识。
本题难度:一般
5、选择题 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度大小关系正确的是( )
A.①>④=②>③
B.④>①>②>③
C.①>②>③>④
D.④>①>②=③
参考答案:通过溶度积是一定温度下的常数,分别得到:①蒸馏水中含银离子浓度和氯离子浓度相同;②0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L;抑制溶解沉淀平衡;③0.1mol?L-1MgCl2溶液中Cl-浓度为0.2mol/l,抑制程度溶解平衡;④0.1mol/L硝酸银溶液中Ag+浓度为0.1mol/L;抑制程度溶解平衡,Cl-浓度越大,Ag+浓度越小,则Ag+离子浓度大小为:④>①>②>③;
故选B.
本题解析:
本题难度:简单