时间:2017-07-27 09:44:12
1、简答题 2011年8月12日,《云南信息报》首度披露?了云南曲靖铬污染事件,引起全国广泛关注.工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为:SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等.
已知:①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌:+3价铬不易被人体吸收,毒性小.
③下表为一些金属氢氧化物沉淀的pH参照数据.
| 物质 | ?开始沉淀 | ?完全沉淀 ?Fe(OH)3 ?2.7 ?3.7 ?Al(OH)3 ?3.7 ?4.7 ?Cr(OH)3 ?4.7 ?a ?Fe(OH)2 ?7.6 ?9.6 ?Mg(OH)2 ?9.6 ?11.1 |
参考答案:(1)根据污水中物质的含量可知,加入硫酸后,除SiO2不溶过滤除去外,其他金属离子均生成其简单阳离子,且Cr为+6价,根据题意可知有毒,需要被还原为+3价,
故答案为:将高价有毒的+6Cr元素含有成无毒的+3Cr;
(2)结合沉淀的pH,溶液由强酸性到4.7,只有Fe(OH)3和Al(OH)3生成.KspCr(OH)3=c(Cr3+)×c3(OH-),若c(Cr3+)=10-5mol/L时,c(OH-)=310-3210-5
本题解析:
本题难度:一般
2、选择题 常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5?mol3?L-3、Ksp(AgCl)=1.8×10-10?mol2?L-2、Ksp?(AgI)=8.3×10-17?mol2?L-2.下列有关说法中,错误的是( )
A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
参考答案:A、在Ag2SO4饱和溶液中,Ksp(Ag2SO4)=7.7×10-5?mol3?L-3=4c3(Ag+),因此c(Ag+)≈8.78×10-2mol/L,
在AgCl饱和溶液中,Ksp(AgCl)=1.8×10-10?mol2?L-2=c(Ag+)?c(Cl-)=c2(Ag+),因此c(Ag+)≈1.34×10-5mol/L
在AgI饱和溶液中,Ksp(AgI)=8.3×10-17mol2/L-2=c(Ag+)?c(I-)=c2(Ag+),因此c(Ag+)≈9×10-8mol/L.
所以常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小,故A正确;
B、AgCl比AgI的溶度积常数大,说明AgI难溶,在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成,故B正确;
C、AgCl和AgI满足,但Ag2SO4不满足,Ksp(Ag2SO4)=[Ag+]2[SO42-],由于含有[Ag+]2项,因此它与另外两种的溶度积之比中含有[Ag+],故C错误:
D、在Ag2SO4饱和溶液中加入Na2SO4固体,[SO42-]增大,Qc>Ksp,故有Ag2SO4沉淀析出,故D正确.
故选C.
本题解析:
本题难度:简单
3、计算题 在100mL 0.01mol/L KCl溶液中,加入1mL 0.1mol/L AgNO3溶液,有没有AgCl沉淀析出?(已知AgCl的 Ksp=1.8×10 -10 mol2· L-2)
参考答案:在难溶电解质溶液中,产生沉淀的唯一条件是 Qc>Ksp,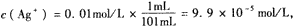
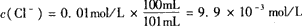
因为Qc= c( Ag+)·c(Cl-)=9.9×10-5 mol/L×9.9×10-3 mol/L=9.8× 10-7 mol2.L-2>Ksp,故有AgCl沉淀析出。
本题解析:
本题难度:一般
4、选择题 向5mL?0.2mol/L的盐酸中加入5mL0.18mol/L?AgNO3溶液生成沉淀,则生成沉淀后溶液中Ag+的物质的量浓度为(已知?Ksp(AgCl)=1.8×10-10)( )
A.不存在
B.1.8×10-6mol/L
C.1.8×10-7mol/L
D.1.8×10-8mol/L
参考答案:5mL?0.2mol/L的盐酸中加入5mL0.18mol/L?AgNO3溶液加入后两者浓度分别为
c(Ag+)=0.182=0.09 (mol/L)
c(Cl-)=0.22=0.1 (mol/L)
Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.1-0.09=0.01(mol/L)
已知:C(Ag+)×C(Cl-)=1.8×10-10,
则:C(Ag+)=1.8×10-100.01=1.8×10-8(mol/L)
故选D.
本题解析:
本题难度:一般
5、选择题 如表为有关化合物的pKsp,pKsp=-lgKsp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入NaZ,沉淀又转化为AgZ。则表中a、b、c的大小关系为( )
| 相关化合物 | AgX | AgY | AgZ |
| pKsp | a | b | c |
参考答案:B
本题解析:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY,这说明AgY的溶度积常数小于AgX的溶度积常数;③向②中加入NaZ,沉淀又转化为AgZ,说明AgZ的溶度积常数小于AgY的溶度积常数。根据pKsp=-lgKsp可知,溶度积常数越小,pKsp越大,所以表中a、b、c的大小关系为a<b<c,答案选B。
点评:该题设计新颖,针对性强,有利于培养学生的学习兴趣,有助于激发学生的学习积极性。明确沉淀转化的原理和溶度积常数与pKsp的关系是答题的关键,有利于培养学生的逻辑推理能力和知识的迁移能力。
本题难度:一般