时间:2017-07-27 09:37:59
1、填空题 (10分)(1)通过NOx传感器可监测NOx的含量,固体体电解质可以传导O2-其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
(2)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
参考答案:(1)①、还原;②、NO+O2--2e-=NO2 ;(2)①A→D ; ②C6H6+6H++6e-==C6H12; ③64.3%
本题解析:(1)①在Pt电极上O2得到电子,被还原,发生还原反应变为O2-;②在NiO电极上NO失去电子,被氧化为NO2,该电极反应式是NO+O2--2e-=NO2 ;(2) ①根据图示可知在左边苯在D上得到电子被还原为环己烷,所以A电极电子多,故导线中电子移动方向为A→D ;②生成目标产物的电极反应式为C6H6+6H++6e-==C6H12;③在右侧阳极OH-失去电子变为氧气,每转移4mol的电子,会产生1mol的氧气,现在产生氧气的物质的量是2.8mol,所以转移电子的物质的量是2.8mol×4=11.2mol;每产生1mol的氧气,会同时产生氢气2mol,则产生2.8mol的氧气的同时还在阴极产生了5.6mol的氢气。假设发生反应消耗的苯的物质的量是xmol,反应消耗氢气的物质的量是3xmol;剩余苯的物质的量是10mol×24%-x,由于反应后苯的含量是:(10mol×24%-x)÷(10-3x+5.6)=10%,解得x=1.2mol,则消耗的电子的物质的量是6×1.2mol=7.2mol,所以该储氢装置的电流效率η=(7.2mol÷11.2mol)× 100% =64.3%。
考点:考查原电池、电解池的反应原理、电极反应及物质的转化效率的知识。
本题难度:困难
2、选择题 下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
参考答案:C
本题解析:由于电流的方向是从电源的a电极到电解池的c,所以a是正极,b是负极。则c的阳极,d的阴极。在电解过程中由于阳离子的放电能力:Cu2+> H+,所以在阴极d电极上发生反应:Cu2++2e-=Cu, d电极质量增加;由于阴离子的放电能力:Cl->OH-,所以在阳极c上发生反应:2Cl-—2e-=Cl2↑.因此氯离子浓度会减小,在c电极上放出黄绿色的气体。因此正确的选项是C。
本题难度:一般
3、选择题 为使反应:Cu+2H2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是
[? ]
A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池
B.用铜片作电极,外接直流电源电解硫酸铜溶液
C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解稀硫酸
参考答案:C
本题解析:
本题难度:简单
4、填空题 已知甲池的总反应为2CH3OH+3O2+4KOH 2K2CO3+6H2O。请回答下列问题:
2K2CO3+6H2O。请回答下列问题: 
(1)甲池是______装置,A(石墨)电极是______极。
(2)写出通入O2的电极的电极反应式:___________________。
(3)乙池中反应的化学方程式为________________。
(4)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2_______mL(标准状况下)。
参考答案:(1)原电池(或化学能转变为电能);阳
(2)O2+2H2O+4e-=4OH-
(3)4AgNO3+2H2O 4Ag+O2↑+4HNO3?
4Ag+O2↑+4HNO3?
(4)280
本题解析:
本题难度:一般
5、填空题 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。 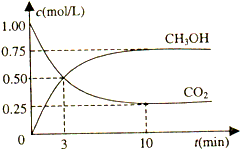
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)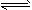 CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从反应开始到平衡,以氢气表示的平均反应速率v(H2)=____________mol·L-1·min-1。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入lmol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2,科研工作者通过某种电化学装置实现了上述目的。该电化学装置内的总反应为:2CO2=2CO+O2,阴极反应式为:
2CO2+4e-+2H2O==2CO+4OH-,则阳极反应为:___________________________。该反应产生的CO会对环境产生污染,有人提出,通过加强热使CO分解的方法来消除污染,请你判断是否可行?________,说出理由:____________________________________________。 (已知反应2CO=2C+O2的△H>O、△S<0)
参考答案:(1)①0.225;②CD
(2)4OH--4e-==O2↑+2H2O;不可行;该反应是一个焓增、熵减的反应,任何温度下都不能自发进行
本题解析:
本题难度:一般