时间:2017-07-27 09:23:40
1、选择题 下列电子式书写正确的是
[? ]
A.
B.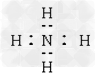
C.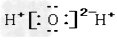
D.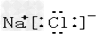
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列说法正确的是
A.离子晶体中可能含有共价键,但不一定含有金属元素
B.分子晶体中一定含有共价键
C.非极性分子中一定存在非极性键
D.对于组成结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高
参考答案:A
本题解析:略
本题难度:简单
3、选择题 下列叙述中,正确的是( )
A.由共价键形成的物质一定是共价化合物
B.只有金属元素和非金属元素化合时才能形成离子键
C.分子中不一定存在化学键
D.离子化合物可能含共价键,共价化合物可能含离子键
参考答案:C
本题解析:
本题难度:一般
4、填空题 (12分)A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大,已知:B的最外层电子排布是nsnnpn+1;C的p能级上未成对的电子比B少一个;D的二价阳离子与C的阴离子具有相同的电子层结构;E与D同周期且E在该周期中原子半径最小;B与A的单质能生成具有刺激性气味的气体,该气体极易溶于水。
(1)B原子核外电子排布式为____________________________。
(2)A与E化合时原子间以_____________键相结合,D与C化合时原子间以_____________键相结合。
(3)写出A、C的单质直接化合形成的化合物与E单质反应的离子方程式:________________________________。
(4)A与B形成化合物时,中心原子采取________杂化成键,其立体结构为________,属于________(填“极性”或“非极性”)分子。
(5) 将白色的无水CuSO4溶解于A2C中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:?。
(6)五种元素中电负性最大的是?(填元素名称)。
参考答案:(共12分,除方程式2分,其余每空1分)
(1)1s22s22p3 2分? (2)共价 离子? 2分
(3)Cl2+H2O===H++Cl-+HClO 2分? (4)sp3 三角锥形 极性? 3分
(5)Cu2++4H2O=[Cu(H2O)4]2+?2分?(6)氧? 1分
本题解析:根据元素的结构及有关性质可知,A、B、C、D、E分别是H、N、O、Mg、Cl。
(1)根据构造原理可知,氮原子的核外电子排布式为1s22s22p3。
(2)H和Cl原子都是非金属,所以二者的形成的化学键是极性键;氧元素是活泼的非金属,镁是活泼的金属,二者形成的化学键是离子键。
(3)A、C的单质直接化合形成的化合物是水,所以和氯气反应的离子方程式是Cl2+H2O===H++Cl-+HClO。
(4)根据价层电子对互斥理论可知,在氨气分子中氮元素含有的孤对电子对数是(5-1×3)÷2=1,所以氨气是三角锥形结构,氮原子是sp3杂化,由于正负电荷不能重合,所以氨气属于极性分子。
(5)硫酸铜中电离出的铁离子能和水分子形成配位键,其中水是配体,配位数是4,所以反应的离子方程式是Cu2++4H2O=[Cu(H2O)4]2+ 。
(6)非金属性越强,电负性越大。由于氧元素的非金属性最强,所以氧元素的电负性最大。
本题难度:一般
5、选择题 X、Y、Z、R为原子序数依次递增的四种主族元素.其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素.下列说法不正确的是( )
A.Z的单质易挥发,可以水封保存
B.Y、Z、R的氢化物的稳定性逐渐减弱
C.127R-的核外含有53个电子
D.在含有Z单质的水溶液中,通入足量XO2气体,溶液的pH会下降
参考答案:X、Y、Z、R为原子序数依次递增的四种主族元素,X的最高正价是最低负价绝对值的3倍,则最高正价为+6,则X为S,X、Y同周期,则Y为Cl;Y、Z、R同主族,R为人体所需的微量元素,则Z为Br,R为I,
A.Z为Br,溴易挥发,保存溴应用水封法,故A正确;
B.同主族元素从上到下非金属性减弱,则Y、Z、R的氢化物的稳定性逐渐减弱,故B正确;
C.R为I,其质子数为53,127R-的核外含127-53+1=75个电子,故C错误;
D.在含有Z单质的水溶液中,通入足量XO2气体,发生Br2+SO2+2H2O═2HBr+H2SO4,酸性增强,pH减小,故D正确;
故选C.
本题解析:
本题难度:简单