时间:2017-07-27 09:22:36
1、选择题 下列说法正确的是(?)
A.难失去电子的原子,易形成阴离子
B.单质分子中不存在化学键,化合物的分子才存在化学键 ()
C.离子化合物中一定含有离子键
D.离子化合物中一定含金属键
参考答案:C
本题解析:A.例如稀有气体元素,具有最稳定的外层结构,不易失去电子,也不易得到电子,所以A不正确。
B.双原子单质分子存在化学键比如O2、N2等单质中存在共价键,不是分子构成的单质也存在化学键比如Fe、Cu存在金属键。单原子分子中不存在化学键比如稀有气体,所以B不正确。
C.离子化合物中一定含有离子键,可能含有共价键,所以C正确。
D.含铵根离子的离子化合物中不含金属键,所以D不正确。
故选C。
点评:本题考查离子键和共价键的比较,题目难度中等。
本题难度:一般
2、选择题 下列说法正确的是( )
A.酸性氧化物在常温下均呈气态
B.元素的非金属性越强,对应离子的还原性也越强
C.非金属元素间相互结合形成的化合物一定是共价化合物
D.共价化合物的分子中一定不含离子键
参考答案:A、常见酸性氧化物为能与酸反应生成盐和水的非金属氧化物,在常温时不一定为气体,如SiO2为酸性氧化物,但常温时为固态,故A错误;
B、根据元素周期律可知,元素的非金属性越强,对应单质在反应中易得电子,但对应离子在反应中难以失去电子,离子的还原性越弱,故B错误;
C、非金属元素间相互结合形成的化合物不一定是共价化合物,如NH4Cl为离子化合物,故C错误;
D、共价化合物的分子只含有共价键,离子化合物一定含有离子键,可能含有共价键,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是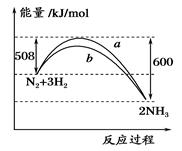
A.加入催化剂,不能改变该化学反应的反应热
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的热化学方程式为:N2(g)+3H2(g)
参考答案:
本题解析:
本题难度:一般
4、选择题 2006年6月8日,“基地”组织在伊拉克的头目扎卡维在美军一次空袭中被打死。扎卡维及其手下多次运用一种名为“N5”的爆炸性极强的“盐粒炸弹”进行恐怖爆炸。迄今为止,人们对“N5”的结构尚不清楚,只知道其实际上是带正电荷的分子碎片,若“N5”的空间结构呈V型对称,5个N原子最外层都达到8个电子结构,且含有2个N≡N,可将其视为“N5n+”,则n值为(?)
A.1
B.2
C.3
D.4
参考答案:A
本题解析:“ ”含2个N≡N三键,且都满足8个电子结构。则其结构为:
”含2个N≡N三键,且都满足8个电子结构。则其结构为: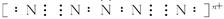 ,此时带电荷n=5×5-24=1。
,此时带电荷n=5×5-24=1。
本题难度:简单
5、选择题 反应A(g)+B(g) 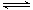 C(g)+D(g)过程中的能量变化如图所示,
C(g)+D(g)过程中的能量变化如图所示, 
①正反应为放热反应,
②反应物总能量低于生成物总能量,
③反应物的总键能小于生成物的总键能,
④1molA与1molB充分反应后,能量变化为ΔE,
⑤加入催化剂后,反应加快,ΔE减小,
⑥反应达到平衡时,升高温度,A的转化率增大,
⑦升高温度可增大正反应速率,降低逆反应速率,
⑧E2是反应C(g)+D(g) 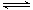 A(g)+B(g) 的活化能,
A(g)+B(g) 的活化能,
以上有关说法正确的是
A.⑤⑥⑦⑧
B.①②③④
C.①③⑤⑦
D.②⑥⑧
参考答案:D
本题解析:①根据图示知道,反应物的能量低于产物的能量,化学反应为吸热反应,故错误;②根据图示知道,反应物的能量低于产物的能量,故正确;③化学反应的实质是旧键的断裂和新键的生成过程,旧键断裂吸收能量,新键生成释放能量,反应是吸热的,反应物的总键能大于生成物的总键能,故错误;④该反应是可逆反应,不能进行充分,故错误;⑤加入催化剂,只能加快化学反应速率,不会引起反应热的变化,故错误;⑥化学反应为吸热反应,升高温度,化学平衡向着吸热方向进行,A的转化率增大,故正确;⑦升高温度可同时增大正逆反应速率,故错误;⑧E2是反应C(g)+D(g)?A(g)+B(g)的活化能,故正确,所以答案为D。
考点:本题考查化学反应的反应热和焓变之间的关系以及平衡的影响因素。
本题难度:一般