时间:2017-07-27 09:22:36
1、选择题 下列实验操作正确的是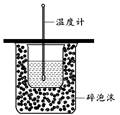
A.用上图装置测定中和热
B.中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化
C.研究H+浓度对该平衡:Cr2O72- + H2O 2CrO42- +2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸
2CrO42- +2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸
D.测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照
参考答案:B
本题解析:A. 右图装置缺少环形玻璃搅拌棒,因此不能准确测定中和热,错误;B.中和滴定过程中,左手控制活塞,右手旋摇锥形瓶,眼睛应注视锥形瓶内溶液颜色的变化,正确;C.研究H+浓度对该平衡:Cr2O72- + H2O 2CrO42- +2H+的影响,往5mL 0.1mol/L K2CrO4溶液滴加少量的稀硫酸,错误;D.测定溶液的pH值时,用干燥洁净的玻璃棒蘸取少量溶液点在干燥的pH试纸上,半分钟后再与标准比色卡对照,错误。
2CrO42- +2H+的影响,往5mL 0.1mol/L K2CrO4溶液滴加少量的稀硫酸,错误;D.测定溶液的pH值时,用干燥洁净的玻璃棒蘸取少量溶液点在干燥的pH试纸上,半分钟后再与标准比色卡对照,错误。
考点:考查实验操作的正误判断的知识。
本题难度:一般
2、选择题 某溶液中可能含有Mg2+、Al3+、SO42-、I-,分别取样进行如下实验:
①加入氯水时,溶液呈黄色,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀;
②加入过量的NaOH溶液,产生白色沉淀.
则下列离子中不能确定其是否存在的是
A.Mg2+
B.Al3+
C.SO42-
D.I-
参考答案:B
本题解析:分析:①加入氯水时,溶液呈黄色,证明有单质碘出现,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,可以是硫酸钡沉淀;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁,证明含有镁离子.
解答:①加入氯水时,溶液呈黄色,证明含有碘离子,碘离子被氯气氧化为碘单质,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,只能是硫酸钡沉淀,证明含有硫酸根离子;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁沉淀,一定会含有镁离子,可能含有铝离子,因为生成的氢氧化铝可以溶于过量的氢氧化钠中.
所以离子中不能确定其是否存在的是铝离子.
故选B.
点评:本题主要考查了根据实验现象判断离子共存,要掌握根据实验现象判断存在的离子,排除与该离子反应的离子.
本题难度:一般
3、填空题 已知某反应A(g)+B(g)
参考答案:
本题解析:
本题难度:一般
4、选择题 下列各分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移的是
A.BeCl2
B.PCl3
C.PCl5
D.N2
参考答案:B
本题解析:根据共用电子对发生偏移,排除D;根据最外层电子数加化合价的绝对值是否等于8判断B正确;故选B。
本题难度:简单
5、选择题 已知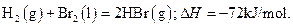 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为
A.404
B.260
C.230
D.200
参考答案:D
本题解析:略
本题难度:简单