时间:2017-07-27 09:22:36
1、选择题 下列反应的离子方程式书写正确的是
A.氯气通入氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O
B.稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓
D.氯化铁溶液与铜粉反应:Cu+Fe3+=Fe2++Cu2+
参考答案:A
本题解析:分析:A.反应生成氯化钠、次氯酸钠、水;
B.反应生成硫酸亚铁和氢气;
C.漏写生成水的离子反应;
D.电荷不守恒.
解答:A.氯气通入氢氧化钠溶液中的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B.稀硫酸与铁粉反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.氢氧化钡溶液与稀硫酸反应的离子反应为SO42-+2H++2OH-+Ba2+=2H2O+BaSO4↓,故C错误;
D.氯化铁溶液与铜粉反应的离子反应为Cu+2Fe3+=2Fe2++Cu2+,故D错误;
故选A.
点评:本题考查离子反应的书写,注意离子方程式的书写规则和各离子的电荷是否守恒,明确沉淀、气体、水在离子反应中保留化学式即可解答,题目较简单.
本题难度:困难
2、选择题 下列离子方程式书写正确的是
A.向饱和NaHCO3溶液中通入过量SO2:SO2+HCO=CO2↑+HSO
B.含等物质的量溶质的亚硫酸氢铵溶液和氢氧化钠溶液的反应:NH+OH-=NH3?H2O
C.澄清石灰水与少量Ca(HCO3)2溶液混合:Ca2++2OH-+2HCO=CaCO3↓+CO+2H2O
D.NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液:Al3++2SO+2Ba2++4OH-=AlO+2BaSO4↓+2H2O
参考答案:A
本题解析:分析:A.反应生成亚硫酸氢钠和二氧化碳;
B.等物质的量溶质的亚硫酸氢铵溶液和氢氧化钠溶液的反应,只发生亚硫酸氢根离子与碱的反应;
C.少量Ca(HCO3)2完全反应,反应生成碳酸钙和水;
D.NH4Al(SO4)2完全反应,反应生成硫酸钡、一水合氨、偏铝酸钡.
解答:向饱和NaHCO3溶液中通入过量SO2的离子反应为SO2+HCO3-=CO2↑+HSO3-,故A正确;
B.含等物质的量溶质的亚硫酸氢铵溶液和氢氧化钠溶液的反应的离子反应为HSO3-+OH-=NH3?H2O+SO42-,故B错误;
C.澄清石灰水与少量Ca(HCO3)2溶液混合的离子反应为Ca2++OH-+HCO3-=CaCO3↓+H2O,故C错误;
D.NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液的离子反应为:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+2H2O+NH3?H2O,故D错误;
故选A.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答的关键,注意与量有关的离子反应及反应的先后顺序为解答的难点,题目难度中等.
本题难度:简单
3、填空题 (8分)下列七种物质中? Ne? O2 ?H2O? NH3? H2SO4? KOH? MgCl2
只含有共价键的是?,只含有离子键的是??,既含有离子键又含有共价键的
是?属于共价化合物的是?,属于电解质的是?。(填化学式)
参考答案:O2、H2O、NH3、H2SO4? MgCl2? KOH? H2O、NH3、H2SO4
H2SO4、KOH、MgCl2、H2O
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。所以只含有共价键的是O2、H2O、NH3、H2SO4。只含有离子键的是MgCl2。既含有离子键又含有共价键的是KOH。全部由共价键形成的化合物是共价化合物,所以H2O、NH3、H2SO4是共价化合物。溶于水或熔融状态下能够导电的化合物是电解质,所以KOH、MgCl2、H2O是电解质。
本题难度:简单
4、填空题 (3分)科学家一直致力于“人工固氮” 的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个1L的密闭容器中充入2molN2和6molH2,反应达平衡时生成NH3的浓度为1 mol·L-1,并放出Q kJ热量,该反应的热化学方程式可表示为 ____ __。
参考答案: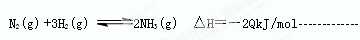
本题解析:从热反应方程式中可以看出生成的是2摩尔的氨气所以放出的热量是2Q,要注意标出物质的状态。
考点:化学反应热书写的相关知识点。
本题难度:一般
5、选择题 在强酸溶液中存在大量的Fe2+和Ba2+,那么在溶液中含有的离子是
A.NO3-
B.SO42-
C.Cl-
D.CO32-
参考答案:C
本题解析:分析:在强酸溶液中存在大量的Fe2+和Ba2+,则具有氧化性的离子以及与Ba2+反应生成沉淀的离子不能大量共存.
解答:A.酸性条件下Fe2+与NO3-发生氧化还原反应,故A错误;
B.Ba2+与SO42-反应生成沉淀而不能都可共存,故B错误;
C.Cl-与Fe2+和Ba2+以及氢离子都不反应,可大量共存,故C正确;
D.酸性条件下CO32-不能大量共存,故D错误.
故选C.
点评:本题考查离子共存问题,综合考查学生元素化合物知识的应用能力,为高考常见题型,题目难度不大,注意常见离子的性质以及反应类型.
本题难度:简单