时间:2017-07-27 09:20:24
1、选择题 有两只串联的电解池(Pt为电极),甲池盛有足量的CuSO4溶液,乙池盛有足量的某硝酸盐的稀溶液.电解时当甲池电极析出6.4gCu时,乙池电极析出21.6g金属,则乙池的溶质可能是( )
A.NaNO3
B.Cu(NO3)2
C.Al(NO3)3
D.AgNO3
参考答案:甲池盛有足量的CuSO4溶液,电解过程中,阴极上的电极反应为:Cu2++2e-=Cu,
当该电极析出6.4gCu即0.1molCu时,转移电子为0.2mol,在转移这些电子的情况下,乙池电极会析出21.6g金属,,设乙池析出金属M,其相对原子量为M,乙池中阴极反应为
? ?Mx++xe-=M,
?1?x? 1
? 0.2mol?2.16M?
则M和x的关系满足:1.08xM=0.1,
将四个选项的金属元素化合价x和相对原子量M代入上式,只有D符合,即x=1,M=108.
故选D.
本题解析:
本题难度:简单
2、填空题 某学生试图用电解法根据电极上析出物质的质量来验证阿佛加德罗常数值,其实验方案的要点为:
①?用直流电电解氯化铜溶液,所用仪器如图: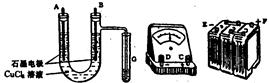
②在电流强度为I安培,通电时间为ts钟后,精确测得某电极上析出的铜的质量为mg。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E接?,C接?,?接F。
实验线路中的电流方向为??→ ?→?→C→ ??→?。
(2)写出B电极上发生反应的离子方程式 ?,G试管中淀粉KI溶液变化的现象为?,相应的离子方程式是?。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是??。(选填下列操作步骤的编号)
①称量电解前电极的质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿佛加德罗常数的计算表达式:NA?。
参考答案:(1)E接D、C接A、B接F;F→B→A→C→D→E
(2)2Cl--2e=Cl2↑;变蓝色;Cl2+2I-=2Cl-+I2
(3)①③④⑥
(4)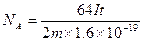
本题解析:本题将物理中电路连接与化学中仪器连接相结合,将电学知识与电解原理相结合,并设置一个利用电解方法来验证阿佛加德罗常数的全新情境,具有一定的深度和灵活性。解题时应将理化相关知识有机融合,方能解决相关问题。
(1)由于U形管右侧有一处理气体的支管,所以可断定B电极为有Cl2生成的一极,即为阳极。显然F应与B连接,A为阴极,结合安培计接入线路的物理知识,A应接C,D接E。
(2)电解CuCl2,阴、阳两极的电极反应式为:
阴极:Cu2++2e=Cu;阳极:2Cl--2e=Cl2↑
生成的Cl2通入G试管,与KI反应,置换出I2,I2可使淀粉溶液呈现蓝色。
(3)为了精确测定电极上析出的铜的质量,显然应采用测定电解前后A电极的增重的方法。具体操作为:在电解前先称量A电极的质量,电解后先用蒸馏水清洗电极(洗去附着的离子),然后需将电极烘干(除去附着的水),为防止Cu被氧化,应在低温下烘干后再进行称量,为防止误差,还应再低温烘干称量,直至恒重。
(4)电解时,当电流强度为IA,通电时间为ts钟内,通过的总电量为:Q=ItC,通过的电子的物质的量为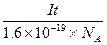 mol。由题意知阴极析出mgCu,转移的电子的物质的量为
mol。由题意知阴极析出mgCu,转移的电子的物质的量为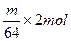 ?。由上述分析可建立等式:
?。由上述分析可建立等式: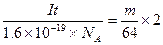 ,?由此式即可得NA的表达式。
,?由此式即可得NA的表达式。
本题难度:一般
3、填空题 (12分)北京2008年奥运会金牌直径为70 mm,厚6 mm。奖牌正面为插上翅膀站立的希腊胜利女神和希腊潘纳辛纳科竞技场。奖牌背面镶嵌着取自中国古代龙纹玉璧造型的玉璧。
(1)环形玉璧由白玉制成。白玉的化学成分可简单看作是Ca2Mg5Si8O22(OH)2,将其改写成氧化物的形式为________________。
(2)为测定金牌的组成,将某去掉白玉的金牌样品,投入到过量稀硝酸中,有无色气体产生,当不再生成气体时,金牌残留一金黄色外壳;将生成的气体与11.2 L O2(标准状况)混合即呈红棕色,最后将其通入水中,所有气体完全被水吸收生成硝酸;再向金牌溶解所得的溶液中滴加氯化钠,立即产生白色沉淀;最后将残壳投入到王水中,随即溶解,生成气体的体积为1.344 L( 标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
①该金牌所含黄金质量为________。
②该金牌除含黄金外还含有另一金属是________(填元素符号),其质量为________。
(3)黄金除能溶于王水外还能溶于氰化钾,反应方程式如下:
①配平该反应,并将计量数填入方框内。
②K[Au(CN)2]可作为电镀金的电镀液,金牌表面的黄金就是通过电镀镀上的。在电镀金牌时,阴极反应式为________________________________。
参考答案:
(1)2CaO·5MgO·8SiO2·H2O
(2)①11.82 g ②Ag 216 g
(3)①4 8 2 1 4 4
②[Au(CN)2]-+e-―→Au+2CN-
本题解析:略
本题难度:简单
4、填空题 (12分)如图为电解装置,X、Y为电极材料,a为电解质溶液。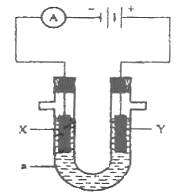
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,电解一段时间后:
X电极附近可观察到的实验现象是 ;
写出Y电极的电极反应式 。
(2)若要实现Cu +H2SO4=CuSO4+H2↑,
则Y电极材料是 ;
写出X电极的电极反应式 。
(3)若要利用该装置在铁制品表面镀上一层银,则a为 ,反应前两电极的质量相等,反应后电极质量相差2.16g,则该过程理论上通过电流表的电子数为 。
(4)若X、Y均为惰性电极,a为NaOH溶液,电解一段时间后,溶液的pH (填“增大”“不变”“减小”),若要使溶液恢复原来的状态,可往溶液中加入 。
参考答案:(1)电极表面产生气体,附近溶液变红; 2Cl- - 2e-=Cl2↑;
(2)Cu;2H++2e-=H2↑;
(3)AgNO3溶液;0.01NA或6.02×1021;
(4)增大;H2O。
本题解析:由题目所给装置图可知,X为Fe作阴极,水中H+得到电子生成氢气,电极附近溶液中OH-浓度增大,溶液变红色;Y为石墨作阳极,Cl-放电生成Cl2,电极反应是2Cl--2e-=Cl2↑;(2)要使非自发反应Cu+H2SO4=CuSO4+H2↑发生需要利用电解原理,以硫酸溶液作电解质溶液,以铜做阳极Y,则在X电极上是H+放电生成H2,阴极电极反应2H++2e-=H2↑;(3) 若要在铁上电镀银,镀层金属银应该做阳极Y,镀件铁做阴极X,硝酸银溶液作电解质溶液,进行电解完成;反应后电极质量相差2.16g,由电镀原理可知:阳极质量减小阴极质量增加的质量相同,即阴极析出银的质量=阳极溶解减小的银的质量=1.08g,可以计算出两极各有0.01molAg的变化量,则理论上电路中通过的电子数为0.01NA或6.02×1021;(4)若X、Y均为惰性电极,a为NaOH溶液,则实质是电解水,溶液浓度增大,溶液PH增大;要使溶液恢复原来的状态,应加入水恢复溶液浓度。
考点: 了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。
点评:认识并正确的分析电化学装置是常见的考查形式,特别是电解池,电镀池。一般重点考查考查两极的判断、两极的简单电极反应的书写或正误判断、电子的转移数目的计算;、考查电解池中阳极材料的选择、两极发生的现象、电解质溶液的变化,如 pH 的变化、离子浓度的变化、考查电解质的复原问题。
本题难度:一般
5、选择题 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
[? ]
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式是:2Cl--2e-===Cl2
D.产生能使1mol二价镍转化为三价镍所需的Cl2,外电路中通过了1mol电子
参考答案:CD
本题解析:
本题难度:一般