时间:2017-07-27 09:12:20
1、计算题 在常温下用惰性电极电解2 L饱和食盐水,电极上通过0.2 mol 电子时停止电解,此时电解生成的NaOH质量是多少?溶液的pH是多少?(溶液的体积变化忽略不计)
参考答案:8 g;13
本题解析:2NaCl+2H2O 2NaOH+Cl2↑+H2↑~2e-
2NaOH+Cl2↑+H2↑~2e-
2×40 g? 2 mol
m(NaOH)? 0.2 mol
m(NaOH)="8" g
n(OH-)=n(NaOH)=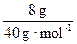 ="0.2" mol
="0.2" mol
c(OH-)=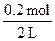 ="0.1" mol·L-1
="0.1" mol·L-1
c(H+)=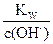 =1×10-13 mol·L-1
=1×10-13 mol·L-1
pH=-lgc(H+)=13。
本题难度:简单
2、填空题 (15分)认真观察下列装置,回答下列问题:
(1)装置B中PbO2上发生的电极反应方程式为 。
(2)装置A中总反应的离子方程式为 。
(3)若装置E中的目的是在Cu材料上镀银,则极板N的材料为 。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为__________________ 。
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下)。
参考答案:19.(1)PbO2+4H++SO42-+2e-=PbSO4+2H2O (2)Cu+2H+ Cu2++H2↑
Cu2++H2↑
(3)Ag 惰性电极(或石墨等不溶性惰性材料) (4)3.92
本题解析:(1)根据装置图可知,BC是原电池,二氧化铅是正极,得到电子,电极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O
(2)A中铜电极和正极相连,是阳极,铜失去电子。阴极是Pt,溶液中的氢离子得到电子,所以总的反应式为Cu+2H+ Cu2++H2↑
Cu2++H2↑
(3)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,所以X是硝酸银溶液,N是阳极,则N是银。由于N是阳极,所以若装置E的目的是验证金属的电化学防腐,则极板N的材料应为惰性电极。
(4)当装置A中Cu电极质量改变6 .4g时,转移电子是6.4g÷64g/mol×2=0.2mol。装置D中氯化钠是0.1mol,阴极是氢离子放电,氢气是0.1mol。阳极是氯离子放电,生成氯气,物质的量是0.05mol,所以阴极还生成氧气,物质的量是0.1mol÷4=0.025mol,所以标准状况下的体积共计是(0.1mol+0.05mol+0.025mol)×22.4L/mol=3.92L.。
考点:考查铅蓄电池,电解。
本题难度:一般
3、选择题 个别电解水设备推销商进行下列电解水实验:将纯净水与自来水进行对比,当电解器插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水中却冒出气泡并生成红褐色或灰绿色的絮状物。推销商趁此解释说自来水中含有对人体有毒有害的物质,长期饮用对身体有害。有关专家解释说,推销商用科学知识诱骗消费者,推销商做实验时用铁棒和铝棒作电极。下列判断错误的是
A.推销商做实验时,用铁棒作阳极
B.电解纯净水和自来水时的现象不同是因为纯净水和自来水所含电解质溶液浓度不同
C.铝棒电极发生的电极反应为Al-3e-===Al3+
D.电解自来水时出现“红褐色或灰绿色的絮状物”是因为产生了铁的氢氧化物
参考答案:C
本题解析:生成红褐色或灰绿色的絮状物,说明应该是铁的化合物生成,所以铁一定是阳极,失去电子,铝是阴极,溶液中的氢离子放电生成氢气,从而破坏阴极周围水的电离平衡,使阴极周围溶液显碱性,从而生成铁的氢氧化物,因此选项C不正确,其余都是正确的,答案选C。
点评:该题的突破点是根据“生成红褐色或灰绿色的絮状物”这一实验现象得出铁做阳极,然后再进行应该判断即可。
本题难度:一般
4、选择题 化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-= Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-= 4OH-
C.粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-= Fe2+
参考答案:A
本题解析:A.电解饱和食盐水时,阳极是Cl-放电生成氯气,电极反应式为:2Cl--2e-= Cl2↑;A项正确;B.氢氧燃料电池的负极失电子,氢气在负极失电子,电极反应式为H2-2e-= 2H+,B项错误;C.粗铜精炼时,粗铜做阳极,纯铜作阴极,与电源正极相连的是粗铜,电极反应式为Cu-2e-=Cu2+,C项错误;D.钢铁发生电化学腐蚀时,Fe作负极,溶解在溶液中的氧气在正极得电子,正极反应式为O2+2H2O+4e-= 4OH-,D项错误;选A。
考点:考查化学用语的正误判断。
本题难度:一般
5、填空题 (1)现有如下两个反应:
(A)NaOH + HCl = NaCl + H2O (B)2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断,____________能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因______________________。
(2)如图所示装置,烧杯中盛有滴有酚酞的NaCl饱和溶液,C(1)、C(2)为多孔石墨电极。 
①接通S1后,两极均有气体生成,C(1)附近溶液显_______________色。装置内发生的总反应化学方程式为______________________________。
②若有11.7g NaCl发生反应,理论上生成Cl2的体积(标准状况)为________________。
③反应一段时间后(电极未脱离液面),断开S1,接通S2,观察到二极管发光。此时:C(2)的电极反应式是
________________________________。
参考答案:(1)①B;②A的反应是非氧化还原反应,没有电子转移?
(1)①红色;2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH;②2.24L;③Cl2+2e-==2Cl-
H2↑+Cl2↑+2NaOH;②2.24L;③Cl2+2e-==2Cl-
本题解析:
本题难度:一般