时间:2017-07-27 08:58:05
1、填空题 [化学一选修3:物质结构与性质](15分)
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未?成对的电子,w的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为_________,1molY2X2含有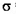 键的数目为____? __________________.
键的数目为____? __________________.
②化合物ZX3的沸点比化台物YX4的高,其主要原因是_____________。
③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
(2)铁元素能形成多种配合物,如:Fe(CO)x
①基态Fe3+的M层电子排布式为___________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18.则x=_________。常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(填晶体类型):
(3)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_________。已知该晶胞的密度为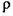 g/cm
g/cm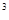 ,阿伏加德罗常数为
,阿伏加德罗常数为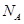 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含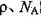 的计算式表示)
的计算式表示)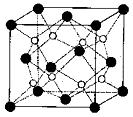
(4)下列有关的说法正确的是_____________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能Ca0比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
2、填空题 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥生产等方面有重要应用。请回答下列问题:
(1)砷原子的核外电子排布式为_____________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________,该化学键能够形成的原因是______________________________________________________。
(3)NH4+中氮原子的杂化类型为________,NH4+的空间构型为________。
(4)已知:
| ? | CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1 073 | 713.2 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
3、选择题 在化学上,常用短线表示化学键。在如图所示的结构中,直线不表示化学键或不完全表示化学键的是?
[? ]
A.石墨 ?
?
B.白磷 ?
?
C.CCl4? ?
?
D.C8H8(立方烷)
4、选择题 CO.BF3.CCl4.CH4都是非极性分子,而NH3.H2S.H2O都是极性分子。由此推出ABn型分子是非极性分子的经验规律正确的是
[? ]
A.所有原子在同一平面内
B.分子中不含氢原子
C.A的原子量小于B
D.在ABn分子中A原子化合价的绝对值等于其最外层电子数
5、填空题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。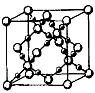
(1)写出B的基态原子的核外电子排布式______________。
(2)A、C形成的最简单分子极易溶于水,其主要原因是______________;与该最简单分子互为等电子体的阳离子为______________。
(3)比较E、F的第一电离能:E________F(选填“>”或“<”)。
(4) BD,在高温高压下所形成的晶胞如上图所示。该晶体的类型属于__________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为___________。
(5)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在______________。
a.极性键 b.非极性键 c.配位键 d.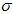 键 e.π键
键 e.π键