时间:2017-07-27 08:58:05
1、填空题 (8分,除(4)题2分外,每空1分)元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式________;该分子中中心原子上的孤电子对数为?,该分子VSEPR模型名称________,分子立体构型名称________?
(2)写出X的质量分数为60%的化合物的σ键电子对数为_______?,分子立体构型为_______??
(3) 写出由宇宙中最丰富的元素Z、短周期中原子半径最大的主族元素W,与X、Y这四种元素组成的两种物质发生化学反应的方程式?
参考答案:(8分,除(4)题2分外,每空1分)
(1)SO2 ;1; 平面三角形;Ⅴ形 (2) 3?平面三角形? (3)?略
本题解析:略
本题难度:一般
2、填空题 已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出12种元素的X的数值:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | N |
| X的数值 | ? | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | ? |
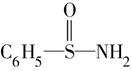 ,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。参考答案:(1)共价键?(2)元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强)原子半径越小,X的数值越大? (3)Br大于I? (4)N?
(5)第六周期第ⅠA族
本题解析:由表中数据可以看出,元素X的数值越大,元素的非金属性越强,所以可以得出,Br的X值小于Cl(2.8),故Al与Br的X值的差值小于1.7,则形成的化学键为共价键;因为N的非金属性大于C,而C和S的X值均为2.5,所以N的X值必定大于S,故S-N中,共用电子对将偏向于N原子;X值最小的元素则金属性最强的元素,为Cs,位于第六周期第Ⅰ主族。
点评:信息题是近几年高考的热点,考生在备考中应学会把握题意和分析数据,利用已学的知识点类比。
本题难度:一般
3、选择题 下列物质中,既含有离子键又含有共价键的是?
[? ]
A.CO2
B.Na2O
C.NH4Cl
D.CaCl2
参考答案:C
本题解析:
本题难度:简单
4、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的( )
A.尽管X与W同族,但W的化合物有多种价态而X的化合物只能形成-2价
B.其最高价氧化物对应的水化物的酸性由弱到强的顺序是元素Q、W、Z
C.Y、Z的常见氧化物可通过加入过量的NaOH溶液来分离.
D.Y单质做的容器可盛装W的最高价含氧酸的浓溶液,Y和Q形成的盐溶液水解呈酸性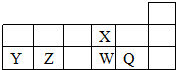
参考答案:D
本题解析:
本题难度:一般
5、选择题 结构研究表明,P4O6分子中各原子的最外层均达到了8电子结构.则该分子中含有的共价键个数共有( )
A.8个
B.9个
C.10个
D.12个
参考答案:D
本题解析:
本题难度:一般