时间:2017-07-27 08:54:47
1、填空题 (1)25℃时,0.1mol?L-1NaOH溶液的pH为______;
(2)25℃时,0.1mol?L-1NH4Cl溶液的pH______7(填“<”、“=”或“>”),其原因是______(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是______(填序号).
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4)25℃时,0.1mol?L-1 NaOH溶液中水电离出来的氢氧根的浓度为c1,0.1mol?L-1 NH4Cl溶液中水电离出来的氢离子的浓度为c2,则c1______c2(填“<”、“=”或“>”).
参考答案:(1)NaOH是强电解质,完全电离,0.1mol/L的NaOH中c(OH-)=0.1mol/L,c(H+)=KWc(OH-)=10-140.1mol/L=10-13mol/L,所以溶液的pH=13,故答案为:13;
(2)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则pH<7,铵根离子水解方程式为NH4++H2O?NH3?H2O+H+,故答案为:<;NH4++H2O?NH3?H2O+H+;
(3)等浓度0.1mol?L-1等体积的NaOH和NH4Cl溶液混合,二者恰好反应生成等浓度0.05mol/L的NaCl和NH3?H2O,一水合氨电离导致溶液呈碱性,所以[OH-]>[H+],根据物料守恒得[Na+]=[Cl-],一水合氨电离程度较小,所以[Cl-]>[OH-],则溶液中离子浓度大小顺序是[Na+]=[Cl-]>[OH-]>[H+],故选C;
(4)酸或碱抑制水电离,含有弱离子的盐促进水电离,NaOH抑制水电离,氯化铵促进水电离,所以c1<c2,故答案为:<.
本题解析:
本题难度:简单
2、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: 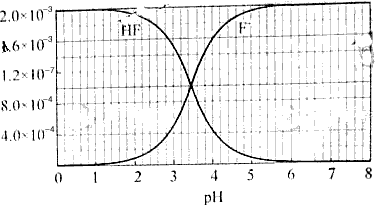 ?
? 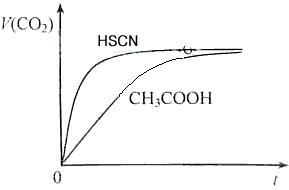
?图2
请根据以下信息回答下旬问题:
(1)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ___________________________________________________________________________________________________________,
②反应结束后所得两溶液中,c(CH3COO-)_______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ ,列式并说明得出该常数的理由 ________________________________________________________________________________________________________。
(3)4.0×10-3 mol/LHF溶液与4.0×10-4 mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
参考答案:(1)①相同的起始条件,只能是因为两种酸的电离度不同导致溶液中起始反应时H+浓度不同引起反应速率的不同。
②反应结束后,溶质为CH3COONa和NaSCN,因CH3COOH酸性弱于HSCN,故CH3COONa水解程度大,c(CH3COO-)<c(SCN-)。
(2)HF电离平衡常数Ka= c(H+)·c(F-)/ c(HF),其中c(H+)、 c(F-)、 c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:PH=4时,c(H+)=10-4, c(F-)=1.6×10-3、 c(HF)=4.0×10-4。Ka=0.4×10-3。
(3)PH=4.0,则c(H+)=10-4,此时:根据HF电离,产生的c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。c2(F-)×c(Ca2+)=5.12×10-10, 5.12×10-10大于Kap(CaF2)=1.5×10-10,此时有少量沉淀产生。
本题解析:
本题难度:一般
3、选择题 室温下浓度为0.1mol/L的三种一元碱溶液:AOH、BOH、COH,其中AOH中的c(OH-)=0.01mol/L,BOH的电离度为1%,COH的c(H+)=1×10-13mol/L,则室温下三种碱所形成的氯化物:ACl、BCl、CCl的溶液在物质的量浓度相同的情况下,其pH由大到小的顺序是( )
A.ACl>BCl>CCl
B.CCl>ACl>BCl
C.CCl>BCl>ACl
D.BCl>ACl>CCl
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,向0.1 mol/L的CH3COONa溶液中逐滴滴加等浓度的HCl溶液,则下列关系正确的是
[? ]
A. c(H+)·c(OH-)=1×10-14
B. c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C. c(Na+)=c(CH3COOH)+c(CH3COO-)
D. c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
参考答案:AC
本题解析:
本题难度:一般
5、选择题 在蒸发皿中用酒精灯加热并灼烧下列物质的溶液,可以得到该物质固体的是( )
A.氯化铝
B.碳酸氢钠
C.硫酸镁
D.高锰酸钾
参考答案:C
本题解析:
本题难度:简单