时间:2017-07-27 08:43:36
1、选择题 根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是I2+SO2+2H2O=H2SO4+2HI? 2FeCl2+Cl2=2FeCl3? 2FeCl3+2HI=2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2
B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2
D.SO2>I->Fe2+>Cl-
参考答案:D
本题解析:考查还原性强弱判断。再氧化还原反应中,还原剂的还原性强于还原产物的,据此可知,选项D正确,答案选D。
本题难度:一般
2、选择题 R、X、Y和Z是四种元素,其常见化合价均为+2价。且X2+与单质R不反应;X2++Z=X+Z2+;
Y+Z2+=Y2++Z。这四种离子的氧化性大小符合
[? ]
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列微粒在氧化还原反应中只能体现还原性的是
A.Na
B.NO2
C.Fe2+
D.H2SO4
参考答案:A
本题解析:略
本题难度:一般
4、选择题 已知在酸性溶液中的还原性强弱顺序为:SO2 > I > H2O2 > Fe
> H2O2 > Fe > Cl
> Cl ,下列反应不可能发生的是
,下列反应不可能发生的是
A.2I + Fe
+ Fe =I2 + Fe
=I2 + Fe
B.2Fe + SO2 + 2H2O=2Fe
+ SO2 + 2H2O=2Fe + SO
+ SO + 4H+
+ 4H+
C.SO2 + 2H2O + I2=H2SO4 + 2HI
D.H2O2 + H2SO4=SO2↑ + O2↑ + 2H2O
参考答案:D
本题解析:A、碘离子的还原性强于亚铁离子,因此铁离子能氧化碘离子生成单质碘和亚铁离子,A正确;B、二氧化硫的还原性大于亚铁离子,所以二氧化硫能还原铁离子生成亚铁离子,能发生,故B正确;C、因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>I-,与已知的还原性强弱一致,能发生,故C正确;D、若该反应发生,S元素的化合价降低,O元素的化合价升高,则H2O2为还原剂,还原性强弱为H2O2>SO2,与已知的还原性强弱矛盾,不可能发生,故D错误,答案选D。
考点:考查氧化还原滴定的应用
本题难度:一般
5、选择题 已知反应:2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3③I2+SO2+2H2O=H2SO4+2HI,判断下列物质的还原能力由强到弱的顺序是(?)
A.I->Fe2+>Cl->SO2
B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2
D.SO2>I->Fe2+>Cl-
参考答案:
D
本题解析:
根据氧化还原反应的规律: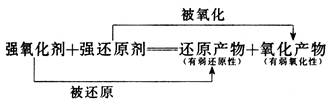
氧化剂得电子后的还原产物,具有一定的还原性,但其还原性小于反应物中的还原剂。由此可知,根据反应方程式可以判断还原能力强弱:由反应①可知:I->Fe2+,反应②可知:Fe2+>Cl-,反应③可知:SO2>I-。综合可得物质的还原能力:SO2>I->Fe2+>Cl-。
本题难度:简单