时间:2017-07-27 08:43:36
1、选择题 常温下,在溶液中可发生以下反应:①16H++10Z-+2 ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是(? )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是(? )
A.氧化性强弱顺序为: <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
参考答案:A
本题解析:氧化还原反应的方程的左边的氧化剂的氧化性大于右边的氧化剂,还原剂的还原性大于右边的还原剂,根据①16H++10Z-+2 ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,可以知道M3+<R2<Z2<
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,可以知道M3+<R2<Z2< ,故A错误,为正确答案;还原性为X2+<Z-<R-<M2+,故B正确;根据①16H++10Z-+2
,故A错误,为正确答案;还原性为X2+<Z-<R-<M2+,故B正确;根据①16H++10Z-+2 ===2X2++5Z2+8H2O,可以知道,Z的化合价升高,所以被氧化,在③2R-+Z2===R2+2Z-,中,Z元素的化学价降低,被还原,故C正确,根据M3+<Z2,可以得到常温下可发生反应2M2++Z2===2M3++2Z-,所以D也正确,所以本题选A。
===2X2++5Z2+8H2O,可以知道,Z的化合价升高,所以被氧化,在③2R-+Z2===R2+2Z-,中,Z元素的化学价降低,被还原,故C正确,根据M3+<Z2,可以得到常温下可发生反应2M2++Z2===2M3++2Z-,所以D也正确,所以本题选A。
点评:本题考查了氧化还原反应知识,根据给出的化学方程式来判断物质的氧化性,氧化还原反应是高考考查的重点和难点,本题有一定的综合性,难度适中。
本题难度:一般
2、选择题 下列有关实验原理或操作正确的是( )
A.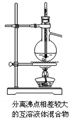
B.
C.
D.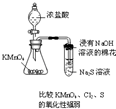
参考答案:A.温度计应位于蒸馏烧瓶的支管口附近,用于测量馏分的温度,故A错误;
B.用长颈漏斗不能密封反应装置,导致气体逸散,应用分液漏斗,故B错误;
C.碳酸酸性比苯酚强,碳酸氢钠与苯酚不反应,无法完成实验,故C错误;
D.高锰酸钾与浓盐酸反应生成氯气,氯气可氧化硫化钠,溶液变浑浊,可通过反应现象判断氧化性强弱,故D正确.
故选D.
本题解析:
本题难度:一般
3、实验题 为验证卤素单质氧化性的相对较弱,某小组用下图装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸,A中产生黄绿色气体。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)D中四氯化碳的电子式是?。
(2)验证氯气的氧化性强于碘的实验现象是?。
(3)B中溶液发生反应的离子方程式是?。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ?。
(5)过程Ⅲ实验的目的是?。
参考答案:(1)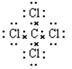 (1分)
(1分)
(2)淀粉KI试纸变蓝?(1分)?(3)Cl2+2Br- =Br2+2Cl-?(1分)
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,(取下D震荡) (2分)
静置后CCl4层溶液(或下层溶液,1分)变为紫红色。(1分)?本小题共4分
(5)确认C的黄色溶液中无Cl2,(1分)排除Cl2对溴置换碘实验的干扰。(2分)
本题解析:(1)四氯化碳是共价化合物,含有极性键,电子式是 。
。
(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,碘与淀粉性蓝色,所以实验现象是淀粉KI试纸变蓝。
(3)氯元素的非金属性强于溴元素的非金属性,所以氯气能和溴化钠反应生成单质溴,反应的离子方程式是Cl2+2Br- =Br2+2Cl-。
(4)由于C中有单质溴生成,所以要验证溴的氧化性强于碘,过程Ⅳ的操作和现象分别是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,(取下D震荡) ,静置后CCl4层溶液(或下层溶液,1分)变为紫红色。
(5)由于氯气也能氧化碘化钾,干扰单质溴和碘化钾的反应,所以过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,难易适中,注重基础知识的考查和能力的训练。该类试题要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
4、选择题 常温下,在下列溶液中发生如下反应:
(1)
(2)
(3)
由此判断,下列说法错误的是
[? ]
A. 反应 可以进行
可以进行
B. Z元素在(1)(3)反应中均被还原
C. 氧化性由强到弱顺序是
D. 还原性由强到弱顺序是
参考答案:B
本题解析:
本题难度:简单
5、选择题 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
A.还原性:I->Fe2+>Br-
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3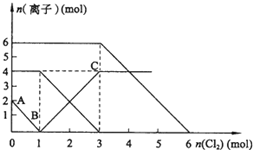
参考答案:A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量
是6mol,即FeBr2的物质的量为3mol,故B错误;
C.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C正确;
D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确.
故选B.
本题解析:
本题难度:简单