时间:2017-07-27 08:43:14
1、填空题 在6份0.01mol/L氨水中分别加入下列各物质:
A.浓氨水?B.纯水?C.少量浓H2SO4D.少量NaOH固体?E.少量Al2(SO4)3固体
(1)能使[OH-]减小、[NH4+]增大的是______
(2)能使[OH-]增大、[NH4+]减小的是______
(3)能使[OH-]和[NH4+]都增大的是______
(4)能使[OH-]和[NH4+]都减小的是______.
参考答案:氨水中存在平衡NH3?H2O?NH4++OH-,
(1)使氢氧根离子浓度减小、铵根离子浓度增大,则加入的物质必须能和氢氧根离子反应,浓硫酸、硫酸铝都和氢氧根离子反应,故选CE;
(2)使氢氧根离子浓度增大、铵根离子浓度减小,则加入的物质必须含有氢氧根离子抑制氨水电离,氢氧化钠加入氨水中,氢氧化钠中含有氢氧根离子,所以抑制氨水电离,但氢氧根离子浓度增大,故选D;
(3)使氢氧根离子和铵根离子浓度都增大,则加入的物质中必须含有铵根离子和氢氧根离子,则浓氨水能使氢氧根离子和铵根离子浓度都增大,故选A;
(4)使氢氧根离子和铵根离子浓度都减小,稀释溶液即可,故选B,
故答案为:CE、D、A、B.
本题解析:
本题难度:一般
2、选择题 用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
[? ]
参考答案:D
本题解析:
本题难度:简单
3、简答题 25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO 电离平衡常数 1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 3.0×10-8 |
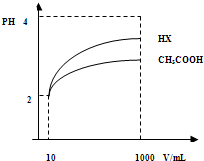
参考答案:(1)由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大,
由表格中的数据可知,酸性CH3COOH>H2CO3>HClO>HCO3-,则水解程度为a>b>d>c,pH由大到小的顺序是a>b>d>c,故答案为:a>b>d>c;?
(2)A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,故A选;
B.c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),则稀释过程中比值变大,故B不选;
C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)?c(OH-)=Kw,Kw不变,故C不选;
D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则c(OH-)/c(H+)变大,故D不选;
故答案为:A;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大,故答案为:大于;HX的pH变化程度大,则酸性HX强,电离平衡常数大;大于;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,故答案为:9.9×10-7mol/L.
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是
A.根据Ksp(PbI2)>Ksp(AgCl)可以得出PbI2在水中的溶解能力比AgCl大
B.常温下,同浓度的Na2CO3与NaHCO3溶液相比,NaHCO3溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.常温下pH=7的氨水与硫酸铵的混合液中c(NH4+)与c(SO42-)之比小于2
参考答案:C
本题解析:A 错误,两种物质的类型不同
B 错误,碳酸根离子水解程度比碳酸氢根离子水解程度大,故同浓度的Na2CO3比NaHCO3溶液碱性强。
C 正确,NH4HSO4电离出氢离子,抑制了铵根离子水解,故NH4HSO4溶液铵根离子浓度大于等物质的量浓度的NH4Cl溶液。
D 错误,因为pH=7,c(NH4+)与c(SO42-)之比等于2。
本题难度:一般
5、选择题 在0.1mol·L一CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO一+H+,对于该平衡,下列叙述不正确的是? (? )
CH3COO一+H+,对于该平衡,下列叙述不正确的是? (? )
A.加入水时,平衡向正反应方向移动,溶液中n(H+)增大
B.加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大
C.加入少量0.1 mol·L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小
参考答案:C
本题解析:A加入水时,促进弱酸的电离,平衡向正反应方向移动,溶液中n(H+)增大,正确;B、加入少量冰醋酸,增大反应物浓度,平衡向正反应方向移动,溶液中c(H+)增大,正确;C、加入少量0.1 mol·L-HCl溶液,H+浓度增大,不正确;D、加入少量CH3COONa固体,CH3COO?浓度增大,平衡向逆反应方向移动,溶液中c(H+)减小,正确。
本题难度:一般