时间:2017-07-27 08:32:02
1、选择题 下列说法正确的是
A.物质发生化学变化不一定伴随着能量变化
B.硫酸钡、醋酸铵、氨水都是弱电解质
C.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
D.在温度、压强一定的条件下,自发反应总是向△H-T△S
参考答案:
本题解析:
本题难度:一般
2、选择题 已知四种盐的溶解度(S)曲线如右图所示,下列说法不正确的是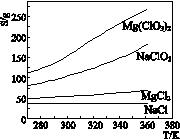
A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.可用MgCl2和NaClO3制备Mg(ClO3)2
D.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
参考答案:B
本题解析:A、因NaCl的溶解度受温度的影响不大,所以将NaCl溶液蒸干可得NaCl固体,故A正确;B、因MgCl2能够水解,水解产生了氢氧化镁和氯化氢,加热水解平衡正向移动,氯化氢易挥发,所以将MgCl2溶液蒸干得到的固体为氢氧化镁,故B错误;C、反应MgCl2+2NaClO3
本题难度:一般
3、填空题 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
参考答案:(1)Mg(OH)2(s) 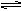 Mg2+(aq)+2OH -(aq)(1分),盐酸中的H+与OH-中和使得OH-浓度减小平衡右移(1分),沉淀溶解
Mg2+(aq)+2OH -(aq)(1分),盐酸中的H+与OH-中和使得OH-浓度减小平衡右移(1分),沉淀溶解
(2)NH4++H2O 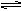 NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
(3)排除实验Ⅰ、Ⅱ中(1分)溶剂水使沉淀溶解的可能性(1分)(只答“4 mL水不能使沉淀溶解”给1分)
(4)溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解(2分)
(5)①沉淀溶解(1分) ②混合溶液显碱性,c(H+)非常小(1分,或答“H+不与OH-结合”), c(NH4+)较大(1分,或答“c(NH4+)与NH4Cl溶液接近”)能确定是NH4+结合OH-使沉淀溶解
本题解析:(1)Mg(OH)2存在沉淀溶解平衡:Mg(OH)2(s) 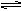 Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH?反应,使OH?浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。
Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH?反应,使OH?浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。
(2)NH4Cl为强酸弱碱盐,NH4+发生水解反应,离子方程式为:NH4++H2O 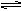 NH3·H2O+H+
NH3·H2O+H+
(3)实验Ⅰ、Ⅱ加入溶液,水增多,所以该实验的目的是:排除实验Ⅰ、Ⅱ中溶剂水使沉淀溶解的可能性。
(4)NH4+能与OH?结合,生成弱电解质NH3?H2O,所以溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解。
(5)①所加的混合液pH约为8,为碱性,所以沉淀溶解,可证明第二种猜测成立。
②混合液pH约为8,显碱性,c(H+)非常小,而NH4+少量溶解,c(NH4+)浓度较大,可确定沉淀溶解的原因是NH4+与OH?反应,促进沉淀溶解平衡向右移动。
考点:本题考查沉淀溶解平衡、盐类的水解、实验方案的分析。
本题难度:困难
4、选择题 醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1 mol/L醋酸钡溶液中粒子浓度比较不正确的是
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
参考答案:A
本题解析:
本题难度:一般
5、选择题 NH4Cl溶液中,下列叙述正确的是
A.c(NH4+)>c(Cl-) >c(OH-) >c( H+ )
B.c(Cl-)>c(NH4+)>c( H+ )>c(OH-)
C.c(NH4+) + c( NH3) = c(Cl-) + c(OH-)
D.c(NH4+) + c( NH3 · H2O) + c( NH3 )= c(Cl-)
参考答案:BD
本题解析:氯化铵由于NH4+水解,溶液显酸性,A不正确,B正确。根据电荷守恒c(NH4+) + c(H+) = c(Cl-) + c(OH-)可知C是错误的。根据氮原子守恒可知,D正确。答案选BD。
本题难度:困难