时间:2017-07-27 08:32:02
1、选择题 下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ks或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
参考答案:C
本题解析:A、根据表中醋酸和次氯酸的电离常数知酸性:CH3COOH>HF,根据盐类水解规律:组成盐的酸根对应的酸越弱该盐的水解程度越大知,相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),错误;B、向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时醋酸根的水解程度大于醋酸的电离程度,溶液pH>7,错误;C、酸性:HCl>H2CO3>HClO>HCO3—,碳酸钠溶液中滴加少量氯水的离子方程式为CO32—+ Cl2+H2O =HCO-3+Cl-+HClO,正确;D、根据AgCl和Ag2CrO4的Ksp判断向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加AgNO3溶液,Cl-沉淀所需的Ag+浓度应大于1.8×10—5 mol·L-1,CrO42—沉淀所需的Ag+浓度应大于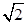 ×10—4.5 mol·L-1,Cl-先形成沉淀,错误。
×10—4.5 mol·L-1,Cl-先形成沉淀,错误。
考点:考查溶液中的离子平衡。
本题难度:困难
2、选择题 下列有关有机物的说法正确的是( )
A.石油裂化和油脂皂化都是高分子生成小分子的过程
B.2-丁醇经消去反应后共得到两种有机物,其中一种的名称是顺-2-丁烯
C.含有6个碳原子的有机物,每个分子中最多可形成5个C-C单键
D.高分子化合物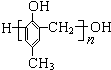
可由对甲基苯酚与甲醛聚合生成
参考答案:D
本题解析:
本题难度:一般
3、选择题 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为
A.0.15 mol·L-1
B.0.2 mol·L-1
C.0.3 mol·L-1
D.0.4 mol·L-1
参考答案:C
本题解析:根据电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),而溶液中c(OH-)很小,可以忽略不计,则有3c(Al3+)+c(K+)+c(H+)=2c(SO42-),所以:c(K+)=2c(SO42-)-3c(Al3+)-c(H+)=2×0.8mol/L-3×0.4mol/L-0.1mol/L=0.3mol/L.故选C.
考点:物质的量浓度
本题难度:一般
4、填空题 常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0.5L混合溶液。
(1)溶液中共有________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是____________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________mol。
参考答案:(1)7 (2)CH3COOH和CH3COO- (3)0.006
本题解析:(1)醋酸钠溶液盐酸,发生反应CH3COONa+HCl=CH3COOH+NaCl。根据物质的量可知,醋酸钠过量,即溶液中含有0.006mol醋酸钠、0.004mol醋酸和0.004mol氯化钠。醋酸存在电离平衡,醋酸钠存在水解平衡,所以含有的微粒是CH3COOH、H2O、H+、OH-、CH3COO-、Na+、Cl-共计是7种。
(2)根据原子守恒可知,CH3COOH和CH3COO-的物质的量之和一定等于0.01mol。
(3)根据电荷守恒可知n(CH3COO-)+n(OH-)+n(Cl-)=n(H+)+n(Na+),所以n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.01mol-0.004mol=0.006mol。
本题难度:困难
5、选择题 将醋酸钠饱和溶液加热
A.碱性增强
B.碱性不变
C.PH不变
D.碱性变弱
参考答案:A
本题解析:
本题难度:简单