时间:2017-07-27 08:13:53
1、选择题 将0.2 mol/L NaF溶液与0.1mol/L稀硝酸等体积混合后,离子浓度的关系正确的是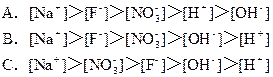
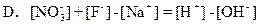
参考答案:A、D
本题解析:A选项:NaF+HNO3=NaNO3+HF? HF是弱酸,部分电离
0.1? 0.1? 0.1? 0.1
则溶液中[Na+]0.2 mol/L,[F-]="0.1" mol/L<0.2 mol/L,[NO3-]0.1 mol/L,[H+]<0.1 mol/L 溶液显弱酸性[H+]>[OH-],D选项:由正负离子浓度相等知。
本题难度:一般
2、选择题 柠檬酸(三元弱酸)可预防和治疗高血压,将0.1mol/L的柠檬酸水溶液加水稀释,该过程中下列微粒浓度增大的是( )
A.柠檬酸分子
B.柠檬酸根
C.H+
D.OH-
参考答案:柠檬酸是弱酸,加水稀释能促进其电离,但柠檬酸根离子、氢离子、柠檬酸分子浓度都减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 升高温度,下列数据不一定同时增大的是
[?]
A.化学反应速率v
B.弱电解质的电离平衡常数Ka
C.化学平衡常数K
D.水的离子积常数KW
参考答案:C
本题解析:
本题难度:一般
4、填空题 (4分)有浓度为0.1 mol?L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol?L-1,b mol?L-1,c mol?L-1,大小顺序为______。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n1 mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为___________________________________________。
(4)与等量锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为________。
参考答案:(1)、b>a>c (2)、n 1=n2 =n3 (3)、V1=V3 >V2或V1=V3 =2V2 (4)、v2>v1>v3
本题解析:(1)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以氢离子浓度大小顺序为a=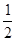 b>c;(2)根据阴离子守恒知,盐的物质的量与酸的物质的量相等,所以生成的盐的物质的量大小关系为n1 =n2=n3; (3)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=2V2=V3;(4)与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中硫酸中氢离子浓度为0.2mol/L,盐酸中氢离子浓度为0.1mol/L,醋酸中氢离子浓度小于0.1mol/L,所以反应速率大小关系为v2>v1>v3。
b>c;(2)根据阴离子守恒知,盐的物质的量与酸的物质的量相等,所以生成的盐的物质的量大小关系为n1 =n2=n3; (3)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=2V2=V3;(4)与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中硫酸中氢离子浓度为0.2mol/L,盐酸中氢离子浓度为0.1mol/L,醋酸中氢离子浓度小于0.1mol/L,所以反应速率大小关系为v2>v1>v3。
考点:考查弱电解质在水溶液中的电离平衡。
本题难度:一般
5、选择题 常温时,下列叙述正确的是( )
A.稀释pH=10的氨水,溶液中所有离子的浓度均降低
B.pH均为5的HCl和NH4Cl溶液中,水的电离程度相同
C.NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)═c(OH-)+c(CH3COO-)
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
参考答案:A.稀释氨水,促进一水合氨电离,溶液中氢氧根离子浓度减小,水的离子积常数不变,则氢离子浓度增大,故A错误;
B.盐酸抑制水电离,氯化铵促进水电离,所以两种溶液中水的电离程度不同,故B错误;
C.根据电荷守恒得c(Na+)+c(H+)═c(OH-)+c(CH3COO-),故C正确;
D.等体积等pH的醋酸和硫酸,醋酸的物质的量大于硫酸中氢离子的物质的量,所以分别中和pH与体积均相同的硫酸和醋酸,醋酸消耗氢氧化钠的物质的量多,故D错误;
故选C.
本题解析:
本题难度:一般