时间:2017-07-27 08:13:53
1、选择题 已知0.1?mol/L的醋酸溶液中存在电离平衡:CH3COOH? CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
[? ]
A.加少量烧碱溶液?
B.升高温度
C.加少量冰醋酸?
D.加水
参考答案:BD
本题解析:
本题难度:一般
2、选择题 如果盐酸的浓度是醋酸浓度的二倍,则该盐酸中H
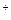 浓度与该醋酸中H
浓度与该醋酸中H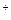 浓度的关系是 (?)
浓度的关系是 (?)
A.前者是后者的2倍
B.前者比后者的2倍大
C.前者比后者的2倍小
D.无法判断
参考答案:B
本题解析:略
本题难度:一般
3、选择题
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液
D.0.5 mol·L-1 KCl溶液
参考答案:B
本题解析:溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05 mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,离子浓度增大,导电能力增强;只有0.5 mol·L-1的盐酸,能与NaOH反应生成强电解质NaCl,不影响导电性。
本题难度:简单
4、选择题
A.1.0×10-7 mol·L-1
B.1.0×10-6 mol·L-1
C.1.0×10-2 mol·L-1
D.1.0×10-12 mol·L-1
参考答案:CD
本题解析:考查学生对不同条件下水电离程度的认识,同时考查学生思维的严密性。先分析pH=12的溶液中c(H+)、c(OH-)的大小。由c(H+)=10-pH得:
c(H+)=1.0×10-12 mol·L-1
c(OH-)=1.0×10-2 mol·L-1
再考虑溶液中的溶质:可能是碱,也可能是强碱弱酸盐。
最后进行讨论:
(1)若溶质为碱,则溶液中的H+都是水电离生成的:
c水(OH-)=c水(H+)=1.0×10-12 mol·L-1
(2)若溶质为强碱弱酸盐,则溶液中的OH-都是水电离生成的:
c水(OH-)=1.0×10-2 mol·L-1
本题难度:一般
5、选择题
L-1的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量
B.电离度
C.H+的物质的量
D.CH3COOH的物质的量
参考答案:BC
本题解析:两溶液中CH3COOH的物质的量都是:0.001 mol,中和时所需NaOH的量也应相等;浓度越小,电离度越大,其电离出的H+的物质的量也就越多。
本题难度:简单